ONKOLOGIE: KASUISTIKEN
Klonale Zytopenie unklarer Signifikanz (CCUS):
Einordnung einer Kasuistik in die Differenzialdiagnosen des myelodysplastischen Syndroms (MDS) und seiner Vorläufer
Clonal Cytopenia of unknown significance (CCUS): Case Report and a discription
of differential diagnosis of myelodysplastic syndrome (MDS) and MDS precursor lesions
Conn Rother a, Armin Riecke a, Thomas Mayer a, Matthias Müller a, Miriam Bandur a, Niklas Gebauer b,
Konrad Steinestel c, Hanno M. Witte a, b, 1
a Bundeswehrkrankenhaus Ulm, Klinik für Innere Medizin/Hämatologie und Onkologie
b Universitätsklinikum Schleswig-Holstein, Campus Lübeck, Klinik für Hämatologie und Onkologie
c Bundeswehrkrankenhaus Ulm, Institut für Pathologie und Molekularpathologie
Zusammenfassung
Diese Arbeit dient der Beschreibung und Abgrenzung von Vorläufer-Läsionen eines myelodysplastischen Syndroms (MDS) anhand einer Fallpräsentation. In der Fallvignette wird das Bild einer klonalen Zytopenie unklarer Signifikanz (CCUS) diagnostiziert. Der Fall wird in die vorliegende Literatur eingeordnet. Die Darstellung soll für differenzialdiagnostische Überlegungen von jüngst (2017) in die WHO-Klassifikation integrierten Diagnosen sensibilisieren, wenn sich ein MDS nicht eindeutig diagnostizieren lässt. Darüber hinaus sollen therapeutische Konsequenzen für die Nachbeobachtung dieser Patienten aufgezeigt werden.
Stichworte: CCUS, CHIP, IDUS, ICUS, MDS, myeloische Neoplasien
Summary
This paper demonstrates clinical and diagnostic features of myelodysplastic precursors. We report a case of clonal cytopenia of undetermined (unknown) significance (CCUS) which we match against the current literature. This case presentation illustrates differential diagnoses of myelodysplastic precursors that recently have been integrated into current issue of World Health Organization (WHO) classification of tumors of hematopoietic and lymphoid tissues (2017). Additionally, this paper reveals therapeutic consequences regarding the follow-up period for these patients.
Keywords: CCUS, CHIP, IDUS, MDS, myeloid neoplasia
Einleitung
Bei einer klonalen Zytopenie unklarer Signifikanz (CCUS, clonal cytopenia of undetermined significance) handelt es sich um eine hämatopathologische Konstellation, die einem myelodysplastischen Syndrom (MDS, myelodysplastic syndrome)) vorausgehen kann. Nicht selten werden bei Patienten zytomorphologische oder sogar molekulargenetische Auffälligkeiten in der Knochenmarkdiagnostik detektiert, die in ihrer Gesamtheit nicht dem vollständigen Bild eines MDS entsprechen. Um diese Auffälligkeiten dennoch in einen voneinander abgrenzbaren hämatologischen Kontext bringen zu können, wurden verschiedene MDS-Vorläufer-Läsionen beschrieben. Diese Vorläufer-MDS-Konstellationen wurden erstmals 2015 übersichtlich durch STEENSMA et al. publiziert [19]. Die Konsequenzen der erhobenen Befunde und die Abgrenzung der unterschiedlichen MDS-Vorläufer untereinander und letztlich zum MDS selbst, sollen in dieser Arbeit anhand der Einordnung einer Fallvignette in die vorliegende Literatur verdeutlicht werden.
Fallpräsentation
Wir berichten von einer 52-jährigen Patientin, die aufgrund einer inzidentell detektierten Thrombozytopenie von 20 Tsd/µl, einer Leukozytopenie von 3,5 Tsd/ul und einer progredienten Infektneigung und dem daraus resultierenden Verdacht auf eine hämatologische Grunderkrankung durch ihren Hausarzt in unserer hämatologischen Abteilung vorgestellt wurde. Zudem wurde von einer zunehmenden Belastungsdyspnoe und ungewöhnlichen Erschöpfungszuständen berichtet. Das Bestehen einer B-Symptomatik wurde ebenso wie das Vorliegen von bemerkten Lymphknotenschwellungen, einer Sicca-Symptomatik und einer Gingivalhyperplasie oder bemerkten Hautveränderungen seitens der Patientin verneint. Aus der körperlichen Untersuchung ergab sich kein weiterer pathologischer Befund. Die Patientin befand sich zum Zeitpunkt der klinischen Konsultation in einem guten Allgemeinzustand 1 (ECOG-PS 2 0). Die einzig bestehende Vorerkrankung war eine Hypothyreose in euthyreoter Stoffwechsellage unter kontinuierlicher L-Thyroxin Substitution.
Im Differenzialblutbild zeigte sich eine makrozytäre Anämie (Hb 11,0 g/dl; MCV 95 fl). Neben der genannten Thrombozytopenie zeigten sich neutrophilen Granulozyten mit 940/ul deutlich vermindert. Die Lymphozyten präsentierten sich normwertig mit 2240/ul. Eosinophile oder basophile Granulozyten zeigten sich ebenso wie Monozyten in ihrer Häufigkeit nicht pathologisch verändert. Die gemessenen Folsäure- und Vitamin B12-Werte konnten keine Mangelsituation detektieren.
In der infektiologischen Diagnostik konnten lediglich durchgemachte Herpes-simplex und EBV-Infektionen beschrieben werden. Insbesondere die Hepatitis-Serologie und die Bestimmung des HIV-Status fielen unauffällig aus. Auch die umfassende rheumatologisch-serologische Diagnostik verlief ohne wegweisende Befundkonstellation.
In der weiteren Umfelddiagnostik, mittels Bodyplethysmografie und Echokardiografie, konnten normale Lungen- und Herzfunktionen beschrieben werden.
In Anbetracht der gestörten Hämatopoese wurde die Indikation zur diagnostischen Knochenmarksaspiration und -stanzbiopsie gestellt.
Knochenmarkdiagnostik
In der Stanzbiopsie konnte histomorphologisch neben der trilinearen Hypoplasie keine Vermehrung von blastären Zellen beschrieben werden (Anteil CD34-positiver Blasten 2 - 3 %). Insbesondere Ringsideroblasten waren nicht nachweisbar. Auffällig war die gestörte Ausreifung von Megakaryozyten im Sinne von Mikromegakaryozyten. Aus zytomorphologischer Sicht konnte eine hämatologische Erkrankung in Form eines myelodysplastischen Syndroms weder ausgeschlossen noch bestätigt werden.
Immunhistochemisch ergaben sich keine Hinweise auf eine Knochenmarksinfiltration durch ein Lymphom. Neben den vorbeschriebenen Mikromegakaryozyten ergaben sich keine neuen Hinweise durch die Immunhistochemie (Abbildung 1).
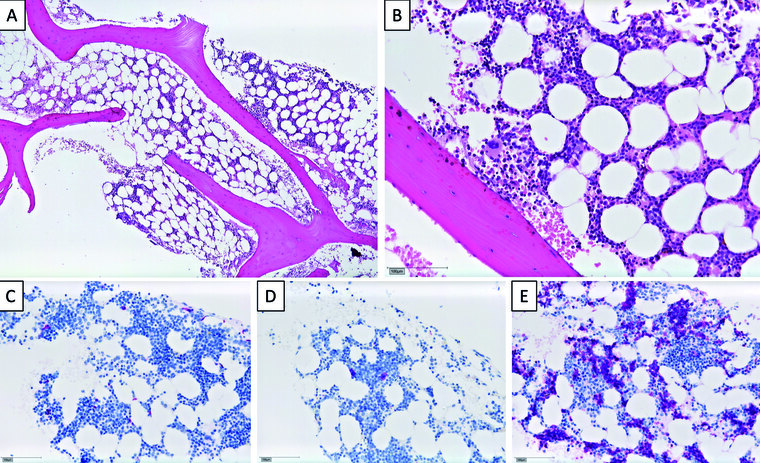
Abb. 1: Histomorphologische und immunhistochemische Diagnostik aus Knochenmark; (A) und (B): H.E.-gefärbte Schnittpräparate der Knochenmarkstanzen mit Nachweis einzelner Mikromegakaryozyten; (C): nur vereinzelte Megakaryozyten in der Immunhistochemie für CD42b; (D): einzelne CD34-positive Blasten; (E): Verbreiterung von erythropoetischen Inseln in der CD71-Immunhistochemie (Bilder: Bundeswehrkrankenhaus Ulm/Priv.-Doz. Dr. Dr. Steinestel)
Zytogenetisch ließ sich ein normaler Karyotyp beschreiben (46, XX). In der anschließenden molekulargenetischen Diagnostik konnte mittels Next-Generation-Sequencing (NGS) lediglich eine DNMT3A Mutation beschrieben werden. In den weiteren untersuchten Genen ließen sich keine Mutationen detektieren. Die Allelfrequenz für diese Mutationen liegt bei 2 % [16].
Darstellung der Differentialdiagnosen
Klonale Hämatopoese von unbestimmtem Potenzial (CHIP, clonal hematopoiesis of indeterminate potential)
Ähnlich wie beim CCUS fehlt hier der eindeutig morphologische Nachweis einer hämatologischen Neoplasie bei gleichzeitigem Nachweis von somatischen Mutationen in hämatopoetischen Zellen. Die Inzidenz einer CHIP steigt mit zunehmendem Lebensalter an und liegt bei über 70-jährigen bei circa 10 %. CHIP-Patienten weisen ein erhöhtes Risiko für eine Progression hin zu einer hämatologischen Neoplasie auf (11- bis 13-fach erhöhtes Risiko). Die jährliche Rate der tatsächlichen Progressionen liegt allerdings bei lediglich 0,5 - 1 %. Ebenso wie die CCUS handelt es sich bei der CHIP um eine Differenzierung, die erst 2015 durch STEENSMA et al. eingeführt wurde. Die CHIP grenzt sich vom CCUS durch das Fehlen einer Zytopenie im peripheren Blutbild ab [19][21]. Auch hier lassen sich am häufigsten Mutationen der Gene DNMT3A, TET2 und ASXL1 als Korrelat einer klonalen Hämatopoese nachweisen [9][12][13][22]. Auch hier lassen sich im Knochenmark keine Dysplasien und keine Vermehrung von Blasten beschreiben.
Idiopathische Zytopenie unklarer Signifikanz (ICUS, idiopathic cytopenia of undetermined significance)
Hier liegt zwar eine Zytopenie im peripheren Blutbild vor, allerdings lassen sich bei der ICUS keine molekularen Aberrationen nachweisen, die auf eine klonale Hämatopoese hinweisen. Die Zellen im peripheren Blut und im Knochenmark weisen bei der ICUS keine dysplastischen Veränderungen auf [19][21].
Idiopathische Dysplasie unklarer Signifikanz (IDUS, idiopathic dysplasia of undetermined significance)
Im Falle einer IDUS zeigen sich Dysplasiezeichen der hämatopoetischen Zellen als möglicher Hinweis auf ein MDS. Im peripheren Differentialblutbild bleibt der Nachweis einer Zytopenie aus. Zudem können in Abgrenzung zum MDS keine molekulargenetischen Aberrationen detektiert werden [19][21].
Abgrenzung zum myelodysplastischen Syndrom (MDS)
CCUS, CHIP, ICUS und IDUS umfassen mögliche Vorstufen eines MDS. Es wird ein fließender Übergang zwischen CCUS, CHIP und MDS angenommen [1][4][5]. Werden bei gleichzeitig vorliegender persistierender Zytopenie zytogenetische Aberrationen nachgewiesen, ist die Diagnose eines MDS zu stellen (Tabellen 1 und 2). Die Komplexizität eines MDS ist aus molekulargenetischer Sicht im Vergleich zur CCUS oder zur CHIP deutlich größer. Entsprechend weist ein MDS meist zwei oder mehr Mutationen auf. Sowohl bei der CHIP, der CCUS als auch beim MDS oder der AML sind die gleichen Gene für Mutationen prädestiniert. Hierzu zählen die sogenannten Spleißosom-Gene (Tabelle 3).
Die beschriebenen MDS-Vorstufen zeichnen sich dadurch aus, dass sie nach unbestimmter Zeit in ein MDS, eine myeloische Neoplasie oder in eine andere hämatologische oder nicht-hämatologische Erkrankung übergehen können. Der Nachweis einer klonalen Hämatopoese ist mit einem erhöhten Risiko für maligne neoplastische Erkrankungen und an sich mit einer erhöhten Mortalität assoziiert [10][12][13]. Das jährliche Risiko für eine myeloische Neoplasie liegt bei Patienten ohne molekulargenetische Aberration bei 1 %.
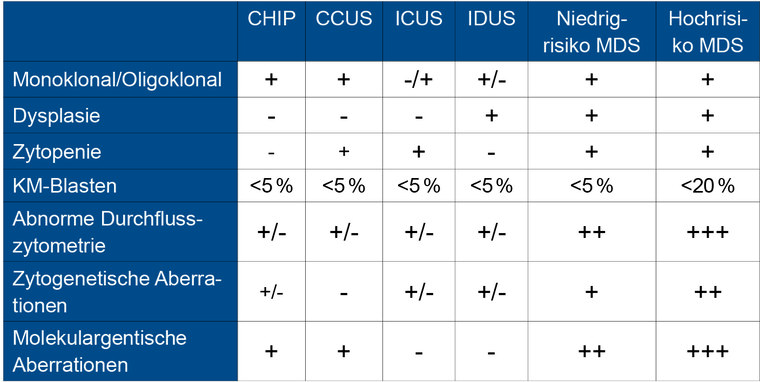
Tab 1: Befundkonstellation von MDS-Vorstufen in Abgrenzung zum MDS [21]
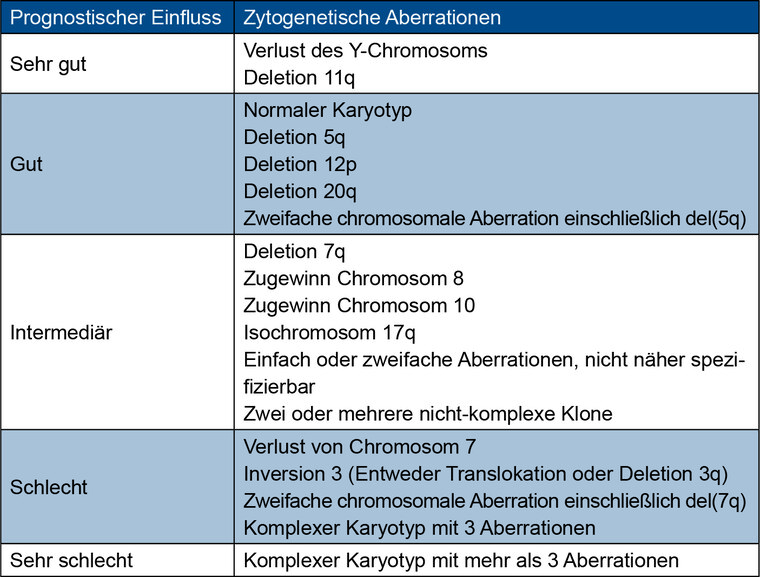
Tab.2: Zytogenetische Aberrationen in myeloischen Neoplasien als Abgrenzung zum CCUS in Anlehnung an Swerdlow et al. [20]
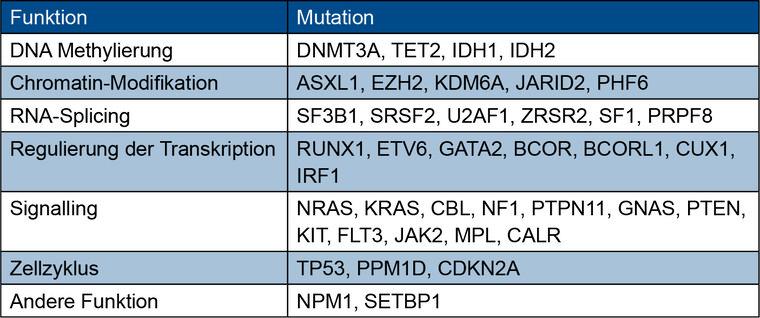
Tab. 3: Driver Mutationen in myeloischen Neoplasien und deren Vorläufern in Anlehnung an DeZern et al. sowie Swerdlow et al. [8, 20].
Einordnung der Kasuistik
Die durchgeführte molekulargenetische Mutationsanalyse mittels NGS unterliegt der aktuell vorliegenden Literaturlage hinsichtlich prognostisch relevanter Mutationen beim myelodysplastischen Syndrom [3][11][17][18]. Metaanalytische Daten von BEJAR et al. zeigten in einem Gesamtkollektiv von 3 000 Patienten eine signifikant verkürzte Überlebenszeit beim Nachweis dieser Mutationen: ASXL1, CBL, EZH2, RUNX1, TP53 und U2AF1 [2]. Die Patienten werden anhand der IPSS-R-Klassifikation 3 in Risikoprofile eingeordnet. Das Vorliegen dieser Mutationen bedeutet die Einordnung in die nächste ungünstigere Risikoklasse. Dagegen wurden ebenfalls Gene analysiert, deren mutierte Variante mit einer günstigeren Prognose einhergeht (SF3B1-Gen) [6].
Bei der in unserem Fall vorliegenden unklaren Zytopenie und dem gleichzeitigen Fehlen von sowohl zytogenetischen als auch morphologischen Merkmalen einer myeloischen Erkrankung belegt der Nachweis der DNMT3 Mutation mittels NGS eine klonale Population, entsprechend einer klonalen Zytopenie unklarer Signifikanz (CCUS) [8][19][21].
Mutationen in Spleißosomgenen, in RUNX1 oder in JAK2 alleine oder aber in Kombination mit ASXL1, DNMT3A oder TET2 Mutationen sind bei CCUS Patienten typisch für eine mögliche bevorstehende Transformation in eine myeloische Neoplasie [16]. Hier liegt das jährliche Progressionsrisiko bei 20 %. In der vorliegenden Kasuistik lag allerdings eine andere Mutationskonstellation vor, die mit einem niedrigeren jährlichen Progressionsrisiko von lediglich 10 % behaftet ist.
Die Übersichtsarbeit von VALENT et al. zu ,,Vorläufer-MDS Situationen‘‘ ermöglicht einen diagnostischen Pfad für Patienten, deren Befundkonstellation nicht eindeutig einem MDS zuzuordnen ist [21]. In Anlehnung an diese Arbeit ist Tabelle 1 entstanden. Angewendet auf die vorliegende Kasuistik lässt sich zusammenfassen, dass eine manifeste Thrombozytopenie mit vornehmlicher Gewichtung der Megakaryopoese, der morphologische und durchflusszytometrische Nachweis von 2 - 3 % Blasten im Knochenmark und das Vorliegen molekulargenetischer Veränderungen (hier Mutation im DNMT3A Gen) bei einem gleichzeitig unauffälligen Karyotypen zur Diagnose eines CCUS führen. Dieses lässt sich anhand der berücksichtigten Merkmale deutlich von einem ICUS oder einer CHIP abgrenzen. Ein Niedrigrisiko- oder Hochrisiko- MDS würde mit zytogenetischen und komplexeren molekulargenetischen Veränderungen einhergehen, die in der vorliegenden Kasuistik nicht eruierbar waren.
Diskussion
Das biologische Verständnis hämatologischer Neoplasien nimmt in den letzten Jahren stets zu. Auf molekulargenetischer Ebene liegen im Zeitalter des Next-Generation-Sequencing zu vielen Krankheitsbildern dezidierte Kenntnisse vor, welche grundlegend für die Diagnosestellung einer hämatologischen Erkrankung sind. Die Einordnung der Histomorphologie ist nach wie vor von großer Bedeutung, um die diagnostische Richtung eines Falles vorzugeben. Der Einsatz zytogenetischer und molekulargenetischer diagnostischer Verfahren gewinnt allerdings zunehmend an Bedeutung, da sie für die endgültige Bestimmung einer Diagnose unabdingbar sind. Mit zunehmendem Erkenntnisgewinn über die Entstehung und die Charakteristika hämatologischer Erkrankungen kommt es im hämatologisch-onkologischen Alltag mittlerweile gehäuft zu Situationen, in denen eine verdächtigte Diagnose nicht endgültig bestätigt werden kann, da nicht sämtliche Charakteristika der Erkrankung erfüllt sind. Daraus lassen sich, wie bereits für Plasmazellneoplasien (Monoklonale Gammopathie unklarer Signifikanz; MGUS) wiederholt beschrieben, assoziierte Vorläuferläsionen beschreiben, die voraussichtlich mit einem Progressionspotenzial für die initial favorisierte Erkrankung einhergehen [7][14][15].
Diese deutlich differenziertere Sichtweise auf hämatologische Erkrankungen bzw. deren Vorläufer zieht eine individuellere Entscheidungsfindung hinsichtlich der Festlegung eines therapeutischen Konzepts nach sich. Diese Arbeit unterstreicht, dass umfassende biologische und genetische Kenntnisse hämatologischer Neoplasien unverzichtbar sind, um eine korrekte Diagnosestellung zu ermöglichen und eine Übertherapie der entsprechenden Patienten zu verhindern.
In der vorliegenden Kasuistik wurde eine CCUS diagnostiziert, welche sich durch fehlende dysplastische, zytogenetische und weniger komplexe molekulargenetische Veränderungen der hämatopoetischen Zellen von einem MDS abgrenzen lässt. Die diffizile Diagnosefindung zeigt die komplexen differenzialdiagnostischen Überlegungen und die detaillierten Diskriminierungen zwischen den unterschiedlichen Diagnosen auf. Letztlich muss die Gesamtheit der Befundkonstellation betrachtet und in Einklang gebracht werden, um ein individuelles patientenbezogenes Konzept festlegen zu können. Der Verzicht auf eine umfassende molekulargenetische Analyse aus Kostengründen erscheint vor diesem Hintergrund fraglich.
Gleichzeitig ist die Diagnose von Vorläufer-Neoplasien eine zusätzliche komplexe Herausforderung im klinischen Alltag. Bisher werden die beschriebenen MDS-Vorläufer eher zufällig diagnostiziert, wenn sich der Verdacht auf ein MDS nicht endgültig bestätigen lässt. Die Implementierung einer standardisierten Vorgehensweise sowie standardisiert festgelegter Verlaufskontrollen ist aktuell noch ausstehend. Eine zentrale Frage ist, wie engmaschig Verlaufsuntersuchungen des Knochenmarks durchgeführt werden sollten. Insbesondere beim Vorliegen einer CHIP oder CCUS liegt bereits eine hämatopoetische Klonalität vor, welche für die Entwicklung einer myeloischen Neoplasie prädestiniert. Fraglich ist zudem der langfristige Einfluss repetitiver Transfusionen im Falle einer CCUS mit relevanter Zytopenie.
In der vorliegenden Kasuistik wurde, ähnlich der Nachbeobachtungsempfehlungen für die MGUS, ein Konzept festgelegt, bei dem 6 Monate nach Diagnosestellung eine erneute Knochenmarkdiagnostik erfolgte, um einen raschen Progress hin zu einer myeloischen Neoplasie auszuschließen. In der Kontrolle konnte das Vorliegen der CCUS bestätigt werden. Anschließend werden klinische Kontrollen und Blutbildkontrollen durchgeführt. Bei erheblichen Verschiebungen des Blutbildes mit ausgeprägter Dynamik sowie der Entwicklung von B-Symptomen als Zeichen einer Konversion hin zu einer myeloischen Neoplasie würde eine Knochenmarkdiagnostik wiederholt werden, um dann entsprechende therapeutische Konsequenzen daraus ziehen zu können.
Fazit
Diese Arbeit verdeutlicht die biologische Komplexizität myeloischer Neoplasien und deren Vorläufer-Läsionen. Im truppenärztlichen Alltag detektierte Zytopenien sollten daher umgehend in hämatologischen Abteilungen mit Anschluss an Möglichkeiten einer umfassende hämatopathologischen Diagnostik überwiesen werden. Die Einschätzung der Verwendungsfähigkeit von Soldaten mit MDS-Vorläufer-Läsionen wird zukünftig ebenfalls eine Herausforderung darstellen.
Erklärungen
Die Verfasser erklären, dass kein Interessenkonflikt im Sinne der Richtlinien des International Committee of Medical Journal Editors besteht.
Die Verfasser möchten sich ausdrücklich für die Zusammenarbeit im Hinblick auf die Entstehung dieser Arbeit und die referenzpathologische Begutachtung bei Herrn Prof. Dr. med. P. Möller, Institut für Pathologie an der Universität Ulm, bedanken.
Literatur
- Bejar R, Greenberg PL: The Impact of Somatic and Germline Mutations in Myelodysplastic Syndromes and Related Disorders. J Natl Compr Canc Netw 2017; 15(1): 131-135. mehr lesen
- Bejar R, Steensma DP: Recent developments in myelodysplastic syndromes. Blood 2014; 124(18): 2793-2803. mehr lesen
- Bejar R, Stevenson K, Abdel-Wahab O et al: Clinical effect of point mutations in myelodysplastic syndromes. N Engl J Med 2011; 364(26): 2496-2506. mehr lesen
- Bejar R: CHIP, ICUS, CCUS and other four-letter words. Leukemia 2017; 31(9): 1869-1871. mehr lesen
- Bejar R: Implications of molecular genetic diversity in myelodysplastic syndromes. Curr Opin Hematol 2017; 24(2): 73-78. mehr lesen
- Broseus J, Alpermann T, Wulfert M et al: Age, JAK2(V617F) and SF3B1 mutations are the main predicting factors for survival in refractory anaemia with ring sideroblasts and marked thrombocytosis. Leukemia 2013; 27(9): 1826-1831. mehr lesen
- Chiecchio L, Dagrada GP, Protheroe RK, Stockley DM, Smith AG, Orchard KH, Cross NC, Harrison CJ, Ross FM, Forum UKM: Loss of 1p and rearrangement of MYC are associated with progression of smouldering myeloma to myeloma: sequential analysis of a single case. Haematologica 2009; 94(7): 1024-1028. mehr lesen
- DeZern AE, Malcovati L, Ebert BL: CHIP, CCUS, and Other Acronyms: Definition, Implications, and Impact on Practice. Am Soc Clin Oncol Educ Book 2019; 39: 400-410. mehr lesen
- Genovese G, Kahler AK, Handsaker RE et al: Clonal hematopoiesis and blood-cancer risk inferred from blood DNA sequence. N Engl J Med 2014; 371(26): 2477-2487. mehr lesen
- Gibson CJ, Lindsley RC, Tchekmedyian V et al: Clonal Hematopoiesis Associated With Adverse Outcomes After Autologous Stem-Cell Transplantation for Lymphoma. J Clin Oncol 2017; 35(14): 1598-1605. mehr lesen
- Haferlach T, Nagata Y, Grossmann V et al: Landscape of genetic lesions in 944 patients with myelodysplastic syndromes. Leukemia 2014; 28(2): 241-247. mehr lesen
- Jaiswal S, Fontanillas P, Flannick J et al: Age-related clonal hematopoiesis associated with adverse outcomes. N Engl J Med 2014; 371(26): 2488-2498. mehr lesen
- Jaiswal S, Natarajan P, Silver AJ t al: Clonal Hematopoiesis and Risk of Atherosclerotic Cardiovascular Disease. N Engl J Med 2017; 377(2): 111-121. mehr lesen
- Lopez-Corral L, Mateos MV, Corchete LA et al.: Genomic analysis of high-risk smoldering multiple myeloma. Haematologica 2012; 97(9): 1439-1443. mehr lesen
- Lopez-Corral L, Sarasquete ME, Bea S et al: SNP-based mapping arrays reveal high genomic complexity in monoclonal gammopathies, from MGUS to myeloma status. Leukemia 2012; 26(12): 2521-2529. mehr lesen
- Malcovati L, Galli A, Travaglino E et al: Clinical significance of somatic mutation in unexplained blood cytopenia. Blood 2017; 129(25): 3371-3378. mehr lesen
- Malcovati L, Papaemmanuil E, Ambaglio I et al: Driver somatic mutations identify distinct disease entities within myeloid neoplasms with myelodysplasia. Blood 2014; 124(9): 1513-1521. mehr lesen
- Papaemmanuil E, Gerstung M, Malcovati L et al: Clinical and biological implications of driver mutations in myelodysplastic syndromes. Blood 2013; 122(22): 3616-3627; quiz 3699. mehr lesen
- Steensma DP, Bejar R, Jaiswal S, Lindsley RC, Sekeres MA, Hasserjian RP, Ebert BL: Clonal hematopoiesis of indeterminate potential and its distinction from myelodysplastic syndromes. Blood 2015; 126(1): 9-16. mehr lesen
- Swerdlow SH, Campo E, Pileri SA et al: The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood 2016; 127(20): 2375-2390. mehr lesen
- Valent P, Orazi A, Steensma DP et al: Proposed minimal diagnostic criteria for myelodysplastic syndromes (MDS) and potential pre-MDS conditions. Oncotarget 2017; 8(43):73483-73500. mehr lesen
- Xie M, Lu C, Wang J, McLellan MD et al: Age-related mutations associated with clonal hematopoietic expansion and malignancies. Nat Med 2014; 20(12): 1472-1478. mehr lesen
Manuskriptdaten
Eingereicht: 13. Februar 2020
Angenommen: 24. März 2020
Zitierweise
Rother C, Roecke A, Mayer T, Müller M, Bandur M, Gebauer N, Steinestel K, Witte HM: Klonale Zytopenie unklarer Signifikanz (CCUS): Einordnung einer Kasuistik in die Differenzialdiagnosen des myelodysplastischen Syndroms (MDS) und seiner Vorläufer. WMM 2020; 64(5): 165-169.
Für die Verfasser
Stabsarzt Hanno M. Witte
Bundeswehrkrankenhaus Ulm
Klinik für Innere Medizin / Hämatologie und Onkologie
Oberer Eselsberg 40, 89081 Ulm
E-Mail: hanno.witte@uksh.de
Manuscript Data
Submitted: 23 February 2020
Accepted: 24 March 2020
Citation
Rother C, Roecke A, Mayer T, Müller M, Bandur M, Gebauer N, Steinestel K, Witte HM: Clonal Cytopenia of unknown significance (CCUS): Case Report and a discription of differential diagnosis of myelodysplastic syndrome (MDS) and MDS precursor lesions. WMM 2020; 64(5): 165-169.
For the authors
Captain (MC) Hanno M. Witte
Bundeswehr Hospital Ulm
Department for Internal Medicine / Hematology and Oncology
Oberer Eselsberg 40, D-89081 Ulm
E-Mail: hanno.witte@uksh.de
1 Beiträge der Autoren:
Studienkonzept: Rother, Witte; Datenerfassung: Rother, Riecke, Witte; Datenanalyse und Erstellung von Tabellen und Abbildungen: Steinestel, Gebauer, Rother, Witte; Erstfassung des Manuskripts: Witte; Korrektur des Manuskripts: alle Autoren.
2 ECOG-PS: Eastern Co-operative Oncology Group – Performance Status; Score, der die Leistungsfähigkeit von Tumorpatienten bewertet; die Skala reicht von 0 (keine Einschränkungen) bis 5 (Tod)
3 IPSS-R: Revised International Prognostic Scoring System