
ORIGINALARBEIT
COVID-19 – klinisch-pathologische Charakteristika von Patienten
mit SARS-CoV-2 assoziiertem respiratorischen Versagen (ARDS)
COVID-19 – clinicopathological characteristics of patients with SARS-CoV-2
related ARDS
Conn Rothera, Birgit Richtera, David Keilholza, Judith Bauera, Vincent G. Umathumb,
Carsten Hackenbrochc, Stephan Opderbecka, Michael Burbacha, Daniel Gagiannisa,
Konrad Steinestelb, Hanno M. Wittea, b 1
a Bundeswehrkrankenhaus Ulm, Klinik für Innere Medizin
b Bundeswehrkrankenhaus Ulm, Institut für Pathologie und Molekularpathologie – Studienzentrum des Deutschen Obduktionsregisters COVID-19 (DeRegCOVID)
c Bundeswehrkrankenhaus Ulm, Abteilung für Radiologie
Zusammenfassung
Die respiratorische Insuffizienz und das akute Atemnotsyndrom (acute respiratory distress syndrome, ARDS) im Rahmen der neuartigen Coronavirus-Erkrankung (COVID-19) sind durch eine langwierige Beatmungstherapie gekennzeichnet. Die direkte virale Schädigung insbesondere der Lunge sowie das Auftreten eines Hyperinflammationssyndroms sind sowohl mit einer multiplen Organbeteiligung als auch mit einer prokoagulatorischen Komponente verbunden, was zu einem komplexen systemischen Krankheitsgeschehen führt.
Wir präsentieren anhand einer prospektiv erhobenen Kohorte von 22 Fällen mit nachgewiesener SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2) Infektion, darunter 11 intensivmedizinisch behandelte Patienten, typische klinisch-pathologische und laboranalytische Parameter sowie Komplikationen und Schwierigkeiten der intensivmedizinischen Therapie.
Schlüsselwörter: COVID-19, SARS-CoV-2, Intensivstation, invasive Beatmung
Summary
Respiratory insufficiency and acute respiratory distress syndrome (ARDS) in coronavirus disease 2019 (COVID-19) patients lead to prolonged invasive ventilation therapy. Virus-induced lung injury and hyperinflammatory syndrome are associated with multiple organ failure as well as procoagulatory activation. These factors characterize a novel type of a complex systemic disease.
In this prospective clinical trial we present a cohort of 22 fully evaluable patients with severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) infection and demonstrate the clinical course of the disease, clinicopathologic and radiologic characteristics and laboratory findings. In 11 patients, intensive care (ICU) treatment was required. The aim of this study was to illustrate different disease-related or treatment-related complications and difficulties regarding the management of severe clinical courses of COVID-19.
Keywords: COVID-19, SARS-CoV-2, intensive care unit, invasive ventilation
Einleitung
Seit der Entdeckung der COVID-19-Erkrankung im November 2019, ausgelöst durch das neuartige ,,severe acute respiratory syndrome coronavirus 2‘‘ (SARS-CoV-2) in Wuhan, Provinz Hubai, kam es zur raschen Entwicklung einer Pandemie [8][15]. Die Letalität dieser neuartigen Erkrankung liegt zwischen 1% und 7% mit einer Schwankungsbreite, die nach aktueller Einschätzung von der Umsetzung politischer Maßnahmen zur Pandemieeindämmung (insbesondere Ausgangsbeschränkungen) sowie von der Verfügbarkeit intensivmedizinischer Behandlungsoptionen abhängt. Mit Stand 30. Juli 2020 waren weltweit 17 116 702 Infektionen und 668 949 Todesfälle aufgetreten. In Deutschland lagen zu diesem Zeitpunkt 209 535 bestätigte Infektionen vor, es wurden 9 144 Todesfälle berichtet.
Virologie
Bei SARS-CoV-2 handelt es sich um ein Beta-Coronavirus, dessen genetische Information auf einem RNA-Einzelstrang hinterlegt ist. Es zeigt eine über 80%ige genetische Identität mit SARS-CoV und eine über 50 %ige zu MERS-CoV (,,Middle East Respiratroy Syndrome Coronavirus‘‘). Als 7.Mitglied humanpathogener Coronaviren (hCoV) gehört es zur Unterfamilie der Orthocoronaviridae. Hierzu zählen weiterhin die Erkältungserreger HCoV-229, HCoV-NL63 sowie die ebenfalls mit inapparenten oder milden Erkrankungen der oberen Atemwege assoziierten Beta-Coronaviren HCoV-OC43 und HCoV-HKU1. Als Ursprungswirt werden Fledertiere angenommen [39].
Erkrankungsübertragung
Der für die zurzeit bestehende Pandemie relevante Übertragungsmechanismus ist die Mensch-zu-Mensch-Übertragung durch Tröpfcheninfektion [57]. Die Invasion der Wirtszellen durch SARS-CoV-2 erfolgt durch die Bindung der Transmembran-Serinprotease 2 (TMPRSS2) der viralen S1 und S1 Spike-Oberflächenproteine an ACE-2-Rezeptoren des oberen und unteren Respirationstraktes sowie durch endosomale Membranfusion [19][39][40][46]. Typischerweise beträgt die Inkubationszeit von COVID-19 bis zu 14 Tage. In Ausnahmefällen kann sich diese bis auf 21 Tage verlängern [57]. Die klinische Verschlechterung bis zur Entwicklung eines ARDS und dem Beginn einer intensivmedizinischen Therapie ereignet sich in der Regel innerhalb der ersten 8 Erkrankungstage [47].
Klinischer Verlauf
Charakteristisch ist ein dreiphasiger klinischer Verlauf [41]. In der ersten milden Phase besteht eine Virusinfektion des oberen Respirationstraktes, welche mit dem Auftreten unspezifischer Allgemeinsymptome assoziiert ist. Das häufigste Symptom ist Fieber (etwa 90% der Fälle), gefolgt von trockenem Reizhusten (etwa 70% der Fälle) und Abgeschlagenheit (etwa 40% der Fälle). Des Weiteren sind Schüttelfrost, Kopfschmerzen, Myalgien und Arthralgien häufig. Seltener kommt es zu gastrointestinalen Symptomen wie Übelkeit, Erbrechen oder Diarrhoen.
Ein Virusnachweis gelingt in dieser Phase mittels RNA-Nachweis in real-time Polymerase-Kettenreaktion (RT-PCR) aus oropharyngealen Abstrichtestungen [35]. Ein weiteres typisches Frühsymptom ist das Auftreten von Anosmie bei bis zu 50% der Patienten, die sich teilweise vor weiteren Symptomen manifestiert [20][22][44]. Als möglicher Pathomechanismus wird eine direkte virale Infiltration des Nervus olfactorius diskutiert [29].
Die zweite, pulmonale Phase beginnt durch die Migration des Virus in den unteren Respirationstrakt [35]. Klinische und radiologische Charakteristika weisen auf eine typische Viruspneumonie hin. Charakteristischerweise treten prolongierter Husten, Fieber und Dyspnoe mit oder ohne Zeichen einer Hypoxämie auf. Histopathologische Analysen in dieser Krankheitsphase zeigen einen akuten, diffusen Alveolarschaden (diffuse alveolar damage, DAD) mit alveolärer Fibrinexsudation. Fibrin, proteinreiches Exsudat und Zelldetritus lagern sich in Form hyaliner Membranen entlang des Alveolarepithels ab und erschweren somit den Gasaustausch [4].
Die dritte (hyperinflammatorische) Phase tritt bei einer Minderheit von Patienten auf und ist durch eine laborchemische Erhöhung von Inflammationsbiomarkern der akuten Phase, wie dem C-reaktiven Protein (CRP), Ferritin, Interleukinen und D-Dimeren, gekennzeichnet. In schweren Fällen kommt es zum Zytokinsturm [13][32][50][54]. Zusätzlich lassen sich Blutbildveränderungen im Sinne einer Neutrophilie und eine für Virusinfektionen typische Lymphozytopenie detektieren. In dieser Phase kommt es zum respiratorischen Versagen mit der Entwicklung eines akuten Atemnotsyndroms (ARDS) und oftmals zu extrapulmonalen Organmanifestationen im Rahmen einer krankheitsassoziierten prokoagulatorischen Aktivierung, welche bis zum Multi-Organversagen führen können [16][21][25][37][39][41][47][56-58]. Im Rahmen der prokoagulatorischen Komponente entwickeln sich eine Mikroangiopathie sowie thromboembolische Ereignisse [9][31]. Auch neurologische oder myokardiale Beteiligungen mit Arrhythmien bis hin zur Herzinsuffizienz oder einem akuten Koronarsyndrom lassen sich beschreiben [2][29]. Schwere Verläufe gehen nicht selten mit einer renalen Beteiligung bis hin zum dialysepflichtigen Nierenversagen einher [36][38].
Radiologische Charakteristika
Computertomografisch lassen sich typische bipulmonale, randständige Milchglasinfiltrate teilweise mit Gefäßmehrzeichnung, interlobuläre Verdichtungen mit sogenanntem ,,crazy-paving“ pattern-Muster und Konsolidierungen mit teilweise positivem Aerobronchopneumogramm darstellen [28][55].
Prognose
Bei etwa 80% der Patienten mit COVID-19 verläuft die Infektion trotz einer teilweise computertomografisch detektierbaren Viruspneumonie mild bis moderat, während sie bei 13,8% der Infizierten schwerwiegend im Sinne eines ARDS nach gültiger Berlin-Klassifikation verläuft [17]. Eine intensivmedizinische Komplextherapie bei schwerwiegenden Verläufen mit respiratorischem Versagen und oftmals assoziierbarem Organversagen ist in 6,1% der Fälle notwendig [49].
Das intensivmedizinische Management der Patienten zeichnet sich durch einen langwierigen und komplikativen Verlauf aus. In bislang publizierten Kohorten lag die Todesrate zwischen 21,9% und 26% [14][51].
In moderaten bis schweren Erkrankungsverläufen kommt es innerhalb von wenigen Tagen zu einer rasanten respiratorischen Insuffizienz mit daraus resultierender Beatmungspflichtigkeit. Speziell für das Beatmungsmanagement konnten bereits zu einem frühen Zeitpunkt der Pandemie nationale und internationale Leitlinien für das COVID-19 induzierte ARDS formuliert werden [7][23].
Vor allem der Behandlung von COVID-19 assoziierten Komplikationen sowie der Einstellung präexistenter Komorbiditäten kam im Rahmen der intensivmedizinischen Versorgung eine entscheidende Bedeutung zu.
Ziel dieser Arbeit ist die Vorstellung von klinisch-laborchemischen und histopathologischen Charakteristika einer am Bundeswehrkrankenhaus (BwKrhs) Ulm im Zeitraum März bis Mai erhobenen Patientenkohorte mit 22 nachgewiesenen SARS-CoV-2-Infektionen. In 11 Fällen war eine intensivmedizinische Komplexversorgung notwendig. Insgesamt verstarben fünf Patienten. Zudem führen wir in der vorliegenden Studie den Vergleich mit bereits publizierten COVID-19-Kohorten hinsichtlich des komplexen und schwierigen klinischen Managements dieser Erkrankung.
Material und Methoden
Im Zeitraum zwischen März und Mai 2020 wurden im BwKrhs Ulm 22 Patienten (10 weiblich, 12 männlich) mit nachgewiesener SARS-CoV-2-Infektion stationär behandelt. Sämtliche Patienten, bei denen mittels RT-PCR aus einem Rachenabstrich, einer Rachenspülung oder einer bronchoalveolären Lavage (BAL) eine SARS-CoV-2-Infektion nachgewiesen werden konnte, wurden in die Studie eingeschlossen. Fünf der 22 COVID-19-Patienten wurden aus dem Ausland an das BwKrhs Ulm transferiert. Die Patienten selbst, deren Angehörige oder der gesetzlich bestellte Betreuer gaben das Einverständnis zur diagnostischen Materialgewinnung während des Behandlungsprozesses. Im Todesfall wurde das Einverständnis der Angehörigen für post mortem durchgeführte Gewebeentnahmen nach den Empfehlungen des Deutschen Obduktionsregisters COVID-19 (DeRegCOVID) eingeholt. Die vorliegende Studie wurde durch die zuständige Ethikkommission der Universität Ulm (Referenznummer 129 - 20) geprüft und freigegeben. Die Erfassung patientenbezogener Daten erfolgte unter Berücksichtigung der Deklaration von Helsinki.
Klinische Charakteristika
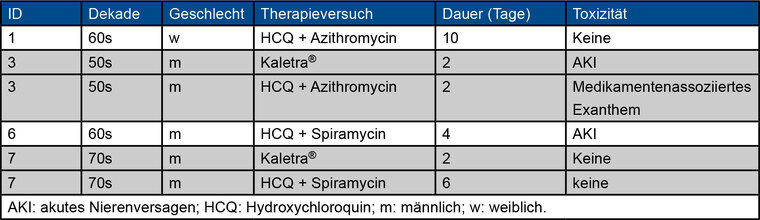
Die Erfassung patientenbezogener Daten erfolgte aus den vorliegenden elektronischen Patientenakten am BwKrhs Ulm. Die Daten wurden an der Quelle anonymisiert. Ausschließlich an der Studie partizipierende Ärzte hatten Zugang zur studienbezogenen Datenbank. Die Datenerfassung umfasste erkrankungsbezogene Ereignisse, Therapieversuche, Komorbiditäten, Befunde der durchgeführten Bildgebung, intensivmedizinische Behandlungscharakteristika und die klinische Nachbeobachtung der Patienten. Ein ARDS wurde nach der gültigen ,,Berlin-Definition‘‘ kategorisiert. Für sämtliche Patienten mit SARS-CoV-2 assoziiertem ARDS wurde ein initialer Horovitz-Quotient (PaO2/FiO2) aus einer arteriellen Blutgasanalyse bestimmt. Zusätzlich wurde die Dauer der Nachweisbarkeit von SARS-CoV-2-RNA mittels RT-PCR erfasst. Aufgrund der fehlenden evidenzbasierten Datenlage zum Zeitpunkt des Studienstarts und der prospektiven Datenerhebung verzichteten wir auf die Etablierung eines antiviralen Therapieversuchs. Lediglich in einem Fall konnte der auswärtig initiierte antivirale Therapieversuch vervollständigt werden (siehe Appendix Tabelle 1).
Intensivmedizinische Behandlung
Für die vorliegende Studie wurden Beatmungsparameter, die Dauer der Beatmung sowie die Durchführung einer Bauchlagerung und das Ansprechen auf diese erfasst. Ein positives Ansprechen auf eine Bauchlagerung wurde definiert als ein Anstieg des Horovitz-Quotienten um 30 mmHg. Ein vollständiger Zyklus einer Bauchlagerung umfasste eine Zeitspanne von 16 Stunden mit anschließender Rückenlagerung für 8 Stunden. Zusätzlich wurde für die intensivmedizinisch behandelten COVID-19-Patienten ein ,,Murray Lung-Injury Score‘‘[33] bestimmt. Die invasive Ventilation erfolgte mit Intensivrespiratoren des Typs Evita IV und Evita XL (Firma Dräger, Lübeck, Deutschland).
Bei beatmeten Patienten (n = 10) wurden in regelmäßigen Intervallen (alle 8 Stunden) die Beatmungsparameter (Beatmungsmodus (CPAP vs. BiPAP®)), PEEP, Pinsp, FiO2, Atemfrequenz, Atemminutenvolumen, Tidalvolumen, endinspiratorischer Spitzendruck, Compliance und Resistance), sowie die Parameter der arteriellen Blutgasanalysen (aBGA) erfasst. Darüber hinaus liegen Daten zur Dauer einer notwendigen Vasopressortherapie und die Notwendigkeit des Einsatzes von Nierenersatzverfahren (kontinuierliche venovenöse Hämodiafiltration mittels Prisma der Firma Fresenius, Bad Homburg, Deutschland) vor. Die Möglichkeit einer extrakorporalen Membranoxygenierung (ECMO) bestand am BwKrhs Ulm nicht.
Laborparameter
Standardmäßig wurden Parameter erfasst, die in der Literatur als mögliche Prädiktoren für den Verlauf von COVID-19 diskutiert werden. Dazu gehört die Bestimmung der Lymphozyten, des Fibrinogens, der D-Dimere, des Ferritins, des Bilirubins und der Laktatdehydrogenase (LDH). Als möglichen Marker einer kardialen Beteiligung wurde regelhaft Troponin-T erfasst. Für den Infektionsverlauf oder die Erfassung von Sekundärinfektionen wurden die Anzahl der neutrophilen Granulozyten, Interleukin-6 (IL-6), Procalcitonin (PCT) und C-reaktives Protein (CRP) bestimmt.
Bildgebung
Eine CT des Thorax erfolgte mittels eines Somatom Force Scanners (Dual Source Scanner 2*192 slices, Siemens, Erlangen, Germany). Die Durchführung der CT-Bildgebung erfolgte entsprechend der durch die Deutsche Gesellschaft für Radiologie verfassten COVID-19-Leitlinie. Für die Beurteilung der CT-Bildgebung wurde die Experten-Konsensus-Stellungnahme der RSNA herangezogen[42]. Entsprechend erfolgte die Einteilung in typische, atypische, unbestimmte und negative Befunde.
Konventionelle röntgenologische Darstellungen des Thorax auf der Intensivstation in anterior-posteriorem Strahlengang wurden mit Hilfe des Mobilett Mira Max (Siemens, Erlangen, Germany) angefertigt.
Histologie und Immunhistochemie
Von insgesamt vier Patienten konnten histologische Proben der Lunge gewonnen werden. In allen vier Fällen wurden transbronchiale Biopsien entnommen. Bei drei verstorbenen Patienten wurde zusätzlich eine partielle Autopsie durchgeführt, bei welcher neben einem ausgedehnten Sampling der Lunge auch Proben von Leber und Herz gewonnen werden konnten. Neben Routinefärbungen zur Darstellung von Fibrin und elastischer Fasern wurden immunhistochemische Färbungen auf CD3, CD68, CK7, CMV und EBV anhand vorverdünnter Antikörper im Rahmen eines automatisierten Färbeverfahrens auf einer VENTANA Plattform (Roche Gewebediagnostik, Mannheim, Deutschland) auf der Basis von Standardprotokollen durchgeführt.
Statistik
Um die erfassten Daten zusammenzufassen und zu visualisieren wurden deskriptive statistische Methoden angewendet. Für die Präsentation von kategorischen Variablen wurden absolute Zahlen und Prozentwerte bestimmt. Die Überprüfung signifikanter Unterschiede zwischen den Subgruppen hinsichtlich kategorischer Variablen erfolgte mit Hilfe des Chi-Quadrat-Tests bzw. des Fisher-Tests. Für kontinuierliche Variablen wurde der Student-T-Test verwendet. Sämtliche statistische Analysen wurden mit der Software GraphPad PRISM 6 (GraphPad Software Inc., San Diego, CA, USA) durchgeführt. Ein p-Wert<0.05 wurde als statistisch signifikant angesehen.
Primäre Studienendpunkte waren Tod oder Entlassung aus dem Krankenhaus. Sekundäre Studienendpunkte waren Ende des Nachbeobachtungsintervalls bei Verlegung an eine externe Klinik zur Entwöhnung der Beatmung oder das Ende des Datenerfassungszeitraums am 31. Mai 2020.
Ergebnisse
Klinische Charakteristika
Die vorgestellte Kohorte differenziert zwischen Patienten (n = 13), bei denen gemäß der gültigen ,,Berlin-Definition‘‘ die Kriterien für ein ARDS erfüllt waren und solche, die die geforderten Kriterien für ein ARDS bei nachgewiesener SARS-CoV-2-Infektion nicht erfüllen (Abbildung 1). Die klinischen Charakteristika der Studienkohorte sind in Tabelle 1 zusammengefasst.
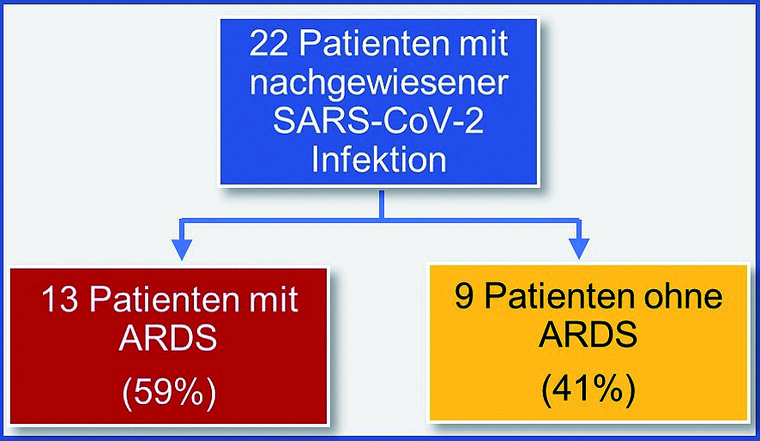
Abb. 1: Flussdiagramm zur Visualisierung der Aufteilung der Gesamtstudienkohorte nach dem Merkmal ARDS (ARDS: akutes respiratorisches Atemnotsyndrom).
Tab 1: Charakteristika der Studienkohorte
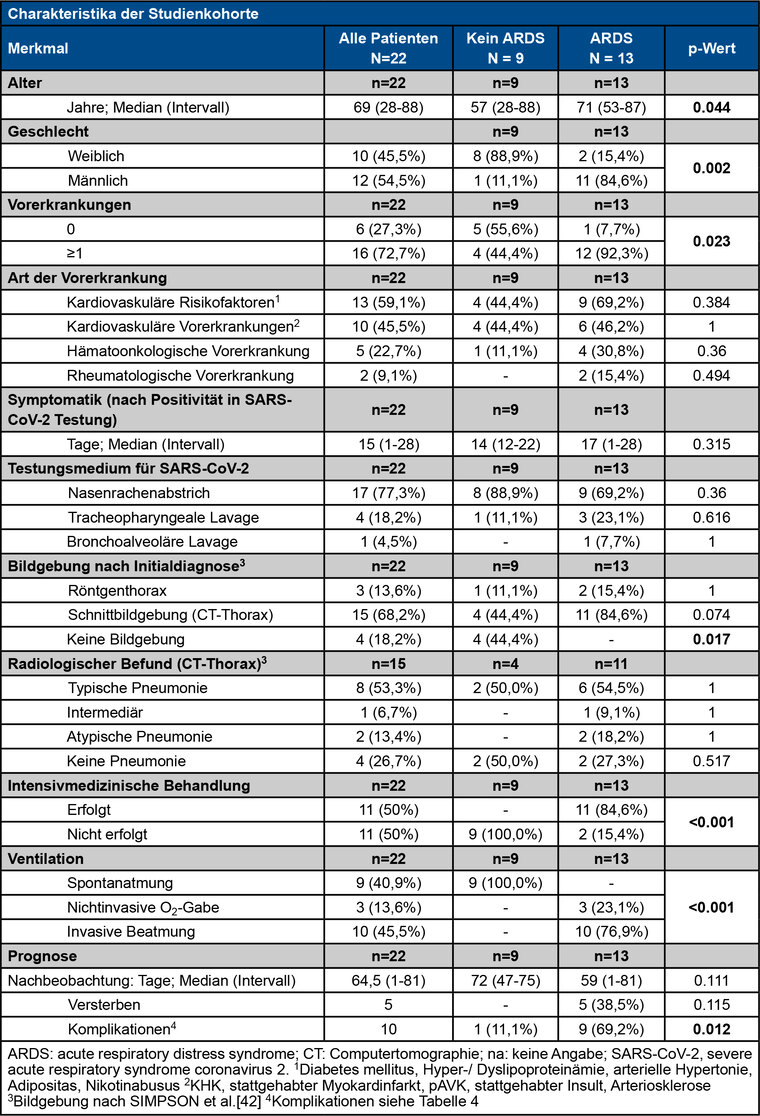
Das mediane Nachbeobachtungsintervall lag bei 64,5 Tagen (Zeitspanne 1 - 81 Tage). Das mediane Erkrankungsalter lag bei 69 Jahren (Altersspanne 28 - 88 Jahre). Der Großteil der Patienten war männlich (n = 12, 54,5 %). Bei 77 % ( n = 17) bestanden Vorerkrankungen (Abbildung 2). Kardiovaskuläre Risikofaktoren lagen bei 13 Patienten (59,1 %) vor (Legende Tabelle 1). Bei Patienten mit mildem Verlauf (ohne Entwicklung eines ARDS) konnte ein Virusnachweis mittels RT-PCR im Median über 14 Tage (Zeitspanne 12 - 22 Tage) geführt werden. Bei Patienten mit einem schweren Verlauf (Entwicklung eines ARDS) waren es 17 Tage (Zeitspanne 1 - 28 Tage).
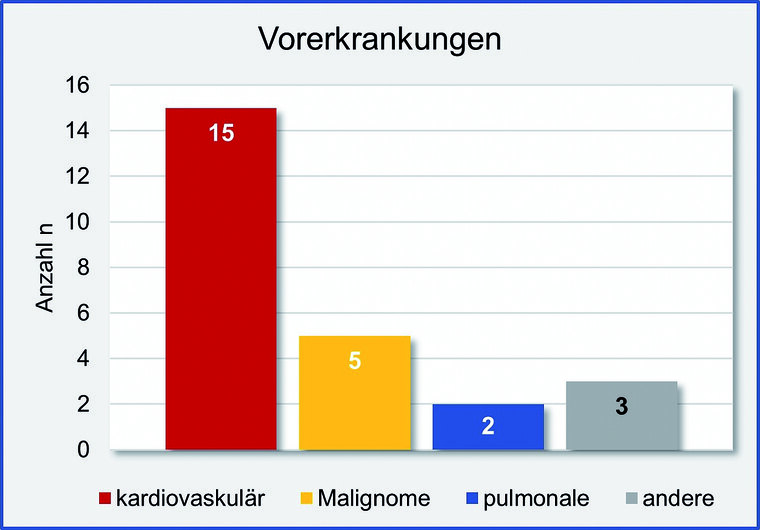
Abb. 2: Vorerkrankungen in der Gesamtkohorte
kardiovaskulär: Herzinsuffizienz, Z.n. Myokardinfarkt, arterielle Hypertonie, Vorhofflimmern, chronische Niereninsuffizienz, Adipositas, Diabetes Mellitus, Hypercholesterinämie, Nikotinabusus
Malignome: Prostatakarzinom (n=3), chronisch lymphatische Leukämie (CLL), kolorektales Karzinom
pulmonal: Chronisch obstruktive Lungenerkrankung (COPD), Interstitielle Lungenerkrankung (ILD)
andere: Hyperurikämie, Hypothyreose, rheumatoide Arthritis
Akutes respiratorisches Atemnotsyndrom (ARDS)
Innerhalb der vorliegenden Studienkohorte entwickelten 59 % (n = 13) der Patienten ein ARDS (Abbildung 1). Eine intensivmedizinische Therapie wurde in 50 % der Fälle (n = 11) begonnen. In 47 % (n = 10) wurde eine invasive Beatmung eingeleitet. Patienten, die ein ARDS entwickelten, waren signifikant älter (p = 0.044), häufiger männlich (p = 0.002) und wiesen signifikant häufiger Vorerkrankungen auf (p = 0.023). ARDS-Patienten wurden signifikant häufiger auf der Intensivstation behandelt (p < 0.001), mussten signifikant häufiger invasiv beatmet werden (p < 0.001) und zeigten ebenfalls signifikant häufiger einen Verlauf mit schweren Komplikationen (p = 0.012, Tabelle 4). Der ,,Murray Lung Injury Score‘‘ wurde für sämtliche Patienten, bei denen eine invasive Beatmung eingeleitet wurde, bestimmt. Gemäß den Kriterien dieses Scores wiesen 8/10 (80 %) ein moderates oder schweres ARDS auf (Median 2,88, Wertespanne 2,0 - 3,5). Innerhalb der Patientengruppe mit ARDS verstarben fünf Patienten (38,5 %) an den Folgen von COVID-19.
Intensivmedizinische Charakteristika
Die intensivmedizinischen Charakteristika sind in Tabelle 2 zusammengefasst. Acht von zehn (80 %) beatmeten Patienten waren männlich. Das mediane Erkrankungsalter in der Kohorte der beatmeten Patienten lag bei 68,9 Jahren (Altersspanne 53 - 81 Jahre) und war damit vergleichbar mit der Gesamtkohorte. Komorbiditäten lagen bei 91 % (n = 10) der intensivmedizinisch behandelten Patienten vor. Am häufigsten zeigten sich kardiovaskuläre Vorerkrankungen (82 %, n = 9). Patienten mit respiratorischem Versagen benötigten im Median 2,5 Tage bis zur Intubation (Zeitspanne 1 - 6 Tage). Die invasive Ventilation musste im Median für 23,5 Tage (Zeitspanne 5 - 34 Tage) durchgeführt werden. Die niedrigsten Horovitz-Quotienten, die für beatmete Patienten ermittelt wurden, lagen zwischen 65 mmHg und 285 mmHg (Median 150 mmHg). Die maximal notwendigen Beatmungsdrücke sind in Abbildung 3 dargestellt. Die niedrigste Compliance, die für beatmete Patienten erfasst wurde, lag im Median bei 45,5 ml/mbar (Wertespanne 30 - 70 ml/mbar).
Tab. 2: Intensivmedizinische Behandlungscharakteristika.
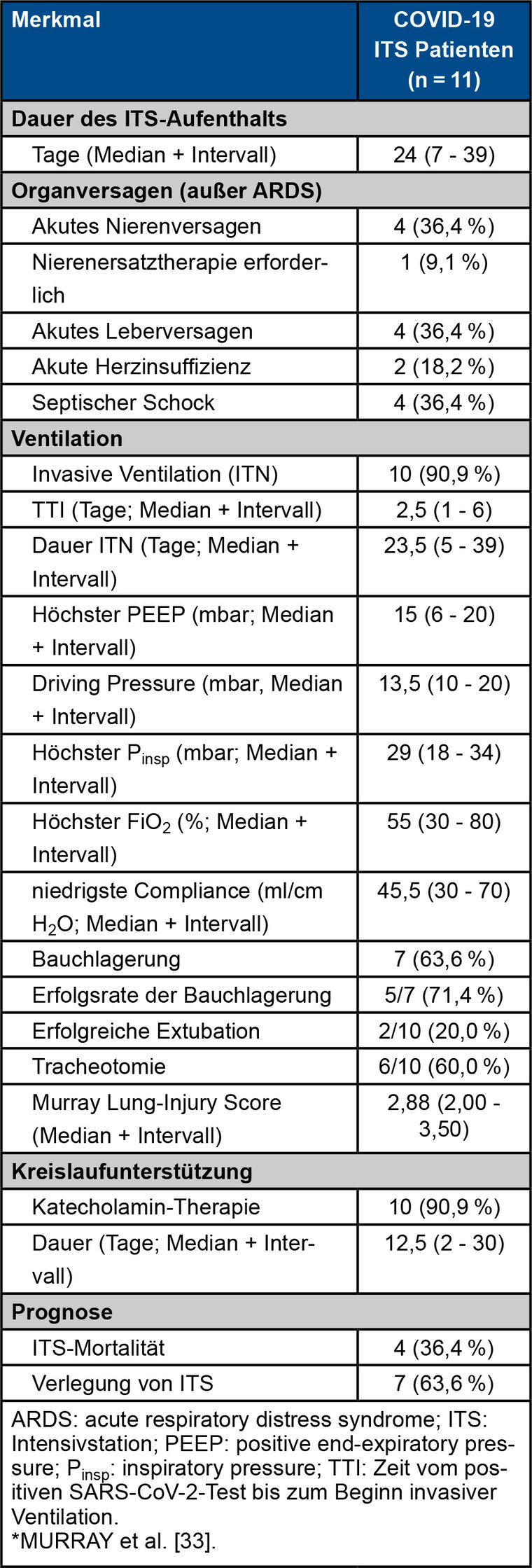
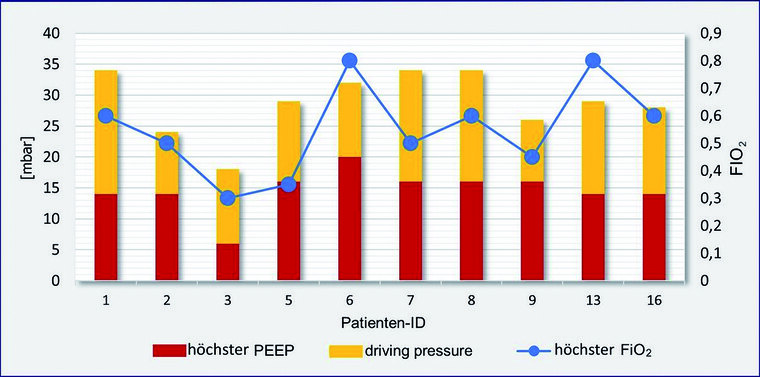
Abb. 3: Fallbezogene Darstellung der maximalen Eskalation der Beatmungsdrücke und der inspiratorischen Sauerstofffraktion
Bei 70 % (n = 7) der beatmeten Patienten wurde eine Bauchlagerungstherapie durchgeführt. Eine zumindest temporäre Verbesserung zeigte sich hierdurch bei 71 % (n = 5).
In der Hälfte der Fälle kam es im Verlauf des stationären Aufenthaltes zu Komplikationen (siehe Abschnitt Komplikationen und Tabelle 4). Die Komplikationsrate lag mit 80 % (n = 9) bei intensivpflichtigen Patienten im Vergleich zu 18 % (n = 2) bei nicht intensivmedizinisch betreuten Patienten höher. Eine begleitende Vasopressortherapie wurde auf der Intensivstation bei zehn Patienten (90,9 %) durchgeführt und war im Median für 12,5 Tage notwendig (Zeitspanne 5 - 39 Tage).
In 60 % (n = 6) der Fälle wurde eine plastische Tracheotomie durchgeführt. Eine primär erfolgreiche Extubation konnte lediglich bei zwei Patienten (20 %) durchgeführt werden. Zum Ende des Erhebungszeitraums waren vier der beatmeten Patienten (40 %) zur Entwöhnungstherapie der Beatmung an spezialisierte Kliniken verlegt worden. Bei drei Patienten zeigte sich im Verlauf in der CT-Bildgebung ein beginnender, fibrotischer Lungengerüstumbau. Für diese Fälle wurde eine Therapie mit Methylprednisolon (n = 2) oder Nintedanib (n = 1) begonnen.
Bildgebung
Mittels CT-Bildgebungen des Thorax konnten bei 53,5 % der Patienten für COVID-19 typische Veränderungen beschrieben werden. Zu diesen Veränderungen gehören Konsolidierungen, Milchglasinfiltrate und Muster einer kryptogen organisierenden Pneumonie (COP) (Abbildung 4). Atypische (nicht für COVID-19 typische) oder keine pathologischen Veränderungen wurden entsprechend bei 46,5 % der Patienten dokumentiert.
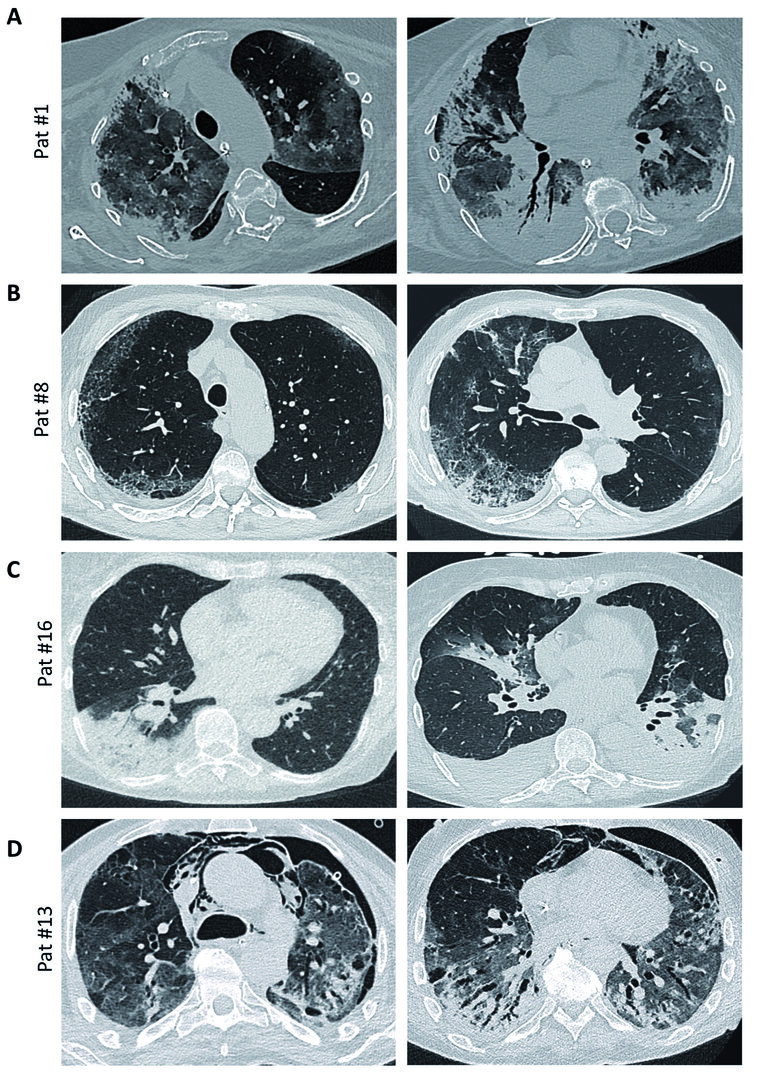
Abb. 4: Beispiele für radiologische Befunde bei Patienten der Studienkohorte
(A) Axiale Darstellung einer Dünnschicht-CT-Aufnahme einer 69-jährigen Patientin mit einem fortgeschrittenen Erkrankungsbild 12 Tage nach Diagnosestellung: Zur Darstellung kommt ein Mischbild aus Milchglasinfiltraten und subpleuralen sowie peribronchialen Konsolidierungen inklusive eines positiven Bronchopneumogramms und Ähnlichkeit zum Bild einer organisierenden Pneumonie.
(B) Axiale Darstellung einer Dünnschicht-CT-Aufnahme eines 80-jährigen Patienten unter dem Verdacht auf eine interstitielle Lungenerkrankung: Rechtsseitig in den peripheren Abschnitten kommen bereits fibrotische Veränderungen zur Darstellung unter Aussparung des subpleuralen Bereichs. Insgesamt kann eine nicht-spezifische interstitielle Lungenerkrankung (NSIP) suspiziert werden. Im linken subpleuralen Bereich zeigen sich Milchglasinfiltrate.
(C) Axiale Darstellung einer Dünnschicht-CT-Aufnahme einer 66-jährigen Patientin: Der linke Bildausschnitt entstammt dem Zeitpunkt der stationären Aufnahme, während der rechte Bildausschnitt 10 Tage nach Diagnosestellung erstellt wurde. Das linke Bild zeigt den typischen Befund einer rechtsseitigen Lobärpneumonie des Unterlappens. Im rechten Bild kommen beidseitig Milchglasinfiltrate und linksbetonte Konsolidierungen zur Darstellung. Gleichzeitig lassen sich beidseitig Pleuraergüsse detektieren.
(D) Axiale Darstellung einer Dünnschicht-CT-Aufnahme eines 58-jährigen Patienten vier Wochen nach Diagnosestellung und Beendigung einer vv-ECMO-Therapie: Neben Milchglasinfiltraten zeigen sich Bronchiektasen sowie zystische Veränderungen und atelektatische Bereiche. Im Verlauf der vv-ECMO-Therapie und einer Langzeitbeatmung mit hohen Beatmungsdrücken entwickelten sich in dieser Kasuistik ein Pneumothorax und ein konsekutives Mediastinalemphysem.
(Bildquelle: Bundeswehrkrankenhaus Ulm – Abteilung für Radiologie)
Histopathologie
Eine Bronchoskopie mit transbronchialer Biopsie (TBB) wurde in vier Fällen durchgeführt. Drei dieser Patienten verstarben. Von diesen wurde nach dem Tode neben einem ausgedehnten Sampling aller Lungenabschnitte im Rahmen einer partiellen Obduktion unter höchsten Sicherheitsvorkehrungen zusätzlich Gewebematerial aus Leber und Herz gewonnen. In den transbronchialen Biopsien zeigten sich reaktiv veränderte Pneumozyten (sog. „Napoleon hat sign“). Zusätzlich waren in den Alveolarlumina proteinreiche Flüssigkeitsansammlungen mit beigemengtem Fibrin nachweisbar. Bei den im Rahmen der partiellen Autopsie entnommenen Gewebeproben der Lunge zeigte sich ein heterogenes Bild mit Ausbildung hyaliner Membranen, fibromyxoiden Organisationsphänomenen mit Einschluss von Fibrinpräzipitat sowie beginnende interstitielle Fibrose mit Pseudo-Honigwabenbildung (Abbildung 5). Die alveolären Kapillaren wiesen Stauung und angedeutete Mikrothrombosierung auf. Thrombosen oder eine entzündliche Mitbeteiligung größerer Gefäße waren hingegen nicht nachweisbar.
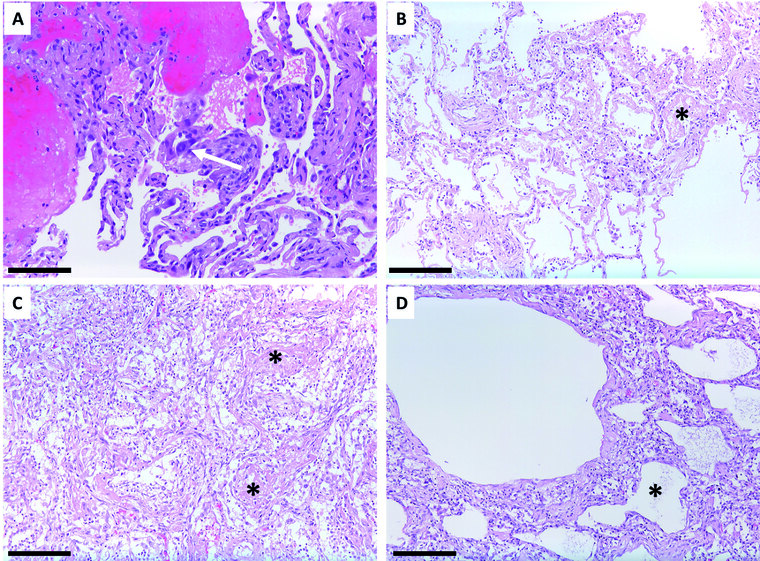
Abb. 5: Histopathologische Befunde
(A) Transbronchiale Biopsie eines 80-jährigen Patienten mit SARS-CoV-2-Nachweis in der bronchoalveolären Lavageflüssigkeit: Es zeigen sich reaktive Zellveränderungen der Pneumozyten (Pfeil, sog. „Napoleon hat sign“) und alveoläres Exsudat mit diskreter Fibrinausfällung (Balken: 100µm).
(B-C) Im Rahmen der partiellen Autopsie gewonnene Lungengewebeproben eines 58-jährigen Patienten mit unterschiedlichen Phasen des diffusen Alveolarschadens:(B) Frühphase mit Ausbildung hyaliner Membranen (*), kaum interstitielle Entzündung, schmale Alveolarsepten; (C) Organisierender diffuser Alveolarschaden mit fibromyxoiden Plugs unter Einschluss verklumpten Fibrins (*), auch als akute organisierende fibrinöse Pneumonie (AFOP) bezeichnet, Ödem der Alveolarsepten;
(D) Spätphase mit Pseudo-Honigwabenbildung und beginnender interstitieller Fibrose, das Bild einer gewöhnlichen interstitiellen Pneumonie (UIP) imitierend (Balken in B-C: 200µm)
(Bildquelle: Bundeswehrkrankenhaus Ulm – Institut für Pathologie)
Laborparameter
Die erfassten Laborparameter sind in Tabelle 3 und Abbildung 6 zusammengefasst. Patienten mit ARDS zeigten im Vergleich zu Patienten ohne ARDS höhere CRP- und IL-6-Werte (jeweils p < 0.05) sowie deutlich erhöhte LDH-Werte (p < 0.01). Keine signifikanten Unterschiede zeigten sich hingegen bei der Anzahl der neutrophilen Granulozyten und der Lymphozyten pro µl (jeweils p > 0.05).
Tab. 3: Darstellung der im Rahmen der Studie erfassten Laborparameter
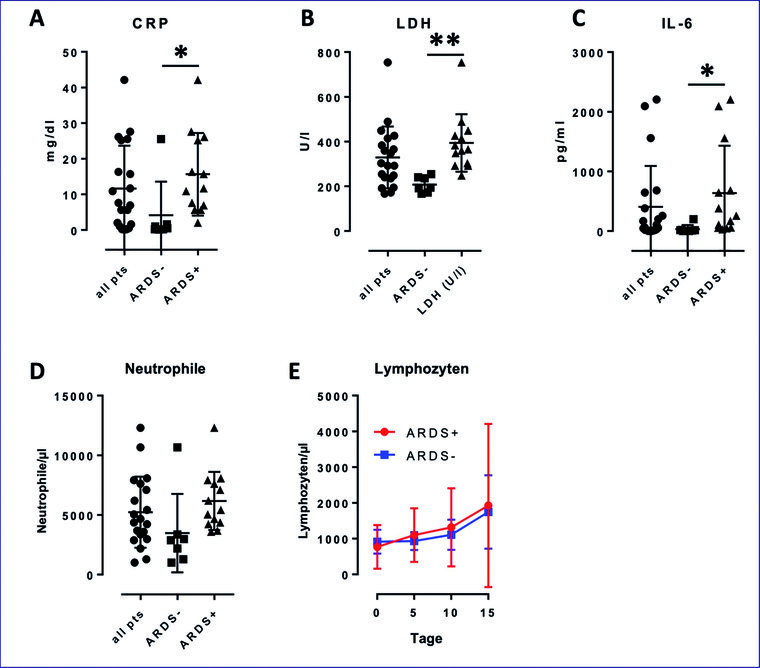
Abb. 6: Darstellung der infektions- und inflammations-assoziierten Laborwerte zwischen ARDS- und Nicht-ARDS-Patienten innerhalb der betrachteten COVID-19-Kohorte mittels Box-Plots
Zudem zeigten sich erhöhte Inflammationsparameter, Akute-Phase-Proteine, sowie D-Dimere. Das Auftreten eines ARDS war mit erhöhtem Troponin T als Zeichen einer myokardialen Mitbeteiligung (im Median 0,023 ng/ml bei ARDS versus 0,013 ng/ml bei nicht-ARDS) assoziiert. Gleichzeitig zeigten ARDS-Patienten einen vermehrten Anfall von Bilirubin mit 0,87 mg/dl im Median im Vergleich zu nicht-ARDS-Patienten mit 0,41 mg/dl im Median. ARDS-Patienten wiesen im Median eine Hypalbuminämie mit 27 g/l auf, während sich für nicht-ARDS Patienten im Median annähernd normwertige Albuminwerte mit 34 g/l eruieren ließen.
Komplikationen und Therapieergebnis
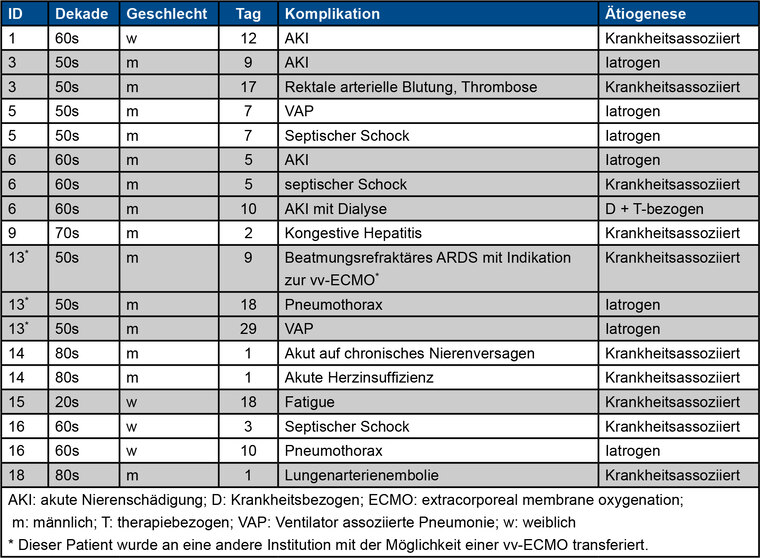
Patienten auf der Intensivstation wiesen behandlungs- und beatmungsassoziierte sowie krankheitsbezogene Komplikationen auf (Tabelle 4). In 55 % der Fälle (n = 12) wurde eine bakterielle Superinfektion vermutet. Eine empirische Antibiose wurde in diesen Fällen begonnen (Appendix Tabelle 2). Ein Erregernachweis oder eine kulturelle Anzucht gelang bei zwei Patienten (16,7 %).
Tab. 4: Komplikationen in der Studienkohorte.
Das mediane Gesamtüberleben der Kohorte lag bis zum Ende des Nachbeobachtungsintervalls bei 64,5 Tagen (Zeitspanne 1 - 81 Tage). Für nichtbeatmete Patienten lag das mediane Gesamtüberleben bei 72 Tagen. Beatmete Patienten wiesen ein medianes Gesamtüberleben von 59 Tagen auf. Die Case-Fatality-Rate (CFR) lag im Gesamtkollektiv bei 18,2 % und für beatmete Patienten bei 22,2 %. Die CFR von Patienten, die auf der Intensivstation behandelt wurden, lag bei 27 %.
Diskussion
Die vorliegende Studie unterstreicht die Komplexität und Heterogenität schwerwiegender Verläufe von COVID-19. Trotz der limitierten Stichprobenzahl von 22 Patienten, von denen 11 einer intensivmedizinischen Komplexbehandlung unterzogen wurden, konnten anhand der klinischen Daten, der Gewinnung von Gewebeproben und der umfassenden radiologischen Diagnostik charakteristische Merkmale von schweren COVID-19-Verläufen herausgearbeitet werden. Gleichzeitig liegt das mediane Nachbeobachtungsintervall der Gesamtkohorte bei 64,5 Tagen und ist damit länger als jenes der meisten bis zum Redaktionsschluss für diesen Beitrag vorliegenden Studien (30.06.2020).
Von 13 Fällen mit Entwicklung eines ARDS verblieben aufgrund einer patientenseitig festgelegten Therapielimitation zwei Patienten auf der Peripherstation. In einem Fall wurde eine invasive Beatmung während des Aufenthalts auf der Intensivstation abgelehnt. Zur Vermeidung einer statistischen Verzerrung bei der geringen Patientenzahl erfolgt die Berechnung der Dauer des Virusnachweises und der CFR am Kollektiv der invasiv beatmeten Patienten.
Einordnung in die Literatur
Tabelle 5 zeigt epidemiologische Merkmale und Verlaufsparameter dieser Kohorte im Vergleich zu ausgewählten und bereits publizierten Kohorten, welche ebenfalls Normal- und Intensivstation geführte Patienten berücksichtigen.
Tab. 5. Dargestellte Kohorte im Literatur-Vergleich.
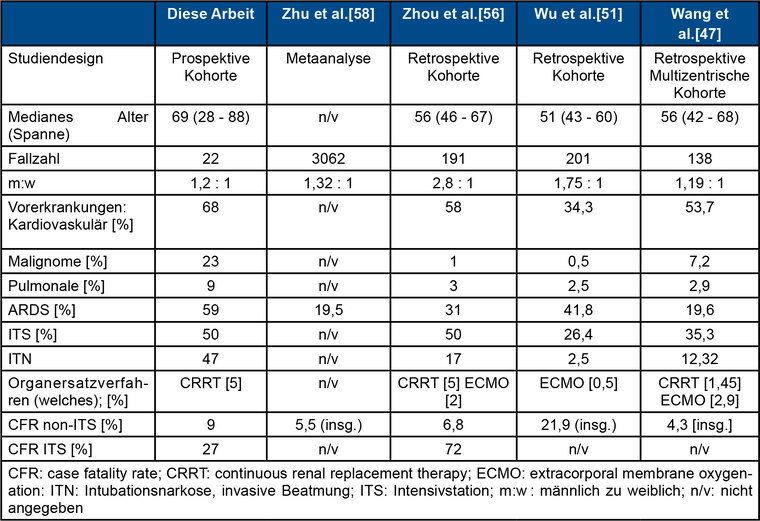
Die Patientenkollektive präsentieren sich stets heterogen in ihrer Zusammensetzung. Die Geschlechtsverteilung weist in der Regel eine Häufung von männlichen Patienten auf (M/W-Verteilung: 1,19 - 2,8 : 1). Hinsichtlich der Komorbiditäten dominieren in allen Kohorten kardiovaskuläre Vorerkrankungen und machen 34,3 % bis 68 % aller Fälle aus. In unserer Kohorte liegt eine höhere ARDS-Rate vor (59 % versus 19,5 %-41,8 %). Ein möglicher Zusammenhang mit dem höheren medianen Alter (69 Jahre versus 51 - 56 Jahre) sowie der höheren Rate an Komorbiditäten ist anzunehmen. Dieser Vergleich beinhaltet keine Berücksichtigung unterschiedlicher demografischer Verteilungen oder das im Verlauf der Pandemie unterschiedliche Management von kritisch kranken COVID-19-Patienten. Die CFR von 27 % unter intensivmedizinisch behandelten Patienten dieser Kohorte ist mit der CFR in der Region Lombardei von 26 % vergleichbar [14].
Beatmungstherapie und deren Folgen
Zur Therapie des respiratorischen Versagens bei COVID-19 wird, äquivalent zur Behandlungsempfehlung des ARDS, der frühzeitige Einsatz einer augmentierten Spontanatmung empfohlen. Im Rahmen der Lungenprotektion soll dabei ein Tidalvolumen (VT) < 6 ml/kg standardisiertes Körpergewicht, einen endinspiratorischen Atemwegsdruck (Ppeak) unterhalb von 30 mbar und eine entsprechende Druckdifferenz (driving pressure) von unter 15 mbar eingehalten werden. Dabei soll ein FiO2 von 0,6 nicht überschritten werden [12][23]. Aus Abbildung 3 und Tabelle 2 ist zu entnehmen, dass diese Vorgaben im Median realisierbar waren. Dennoch ist zeitweise eine Überschreitung des endinspiratorischen Spitzendrucks oberhalb von 30 mbar in der invasiv beatmeten Kohorte in 40 % der Fälle notwendig gewesen. In 30 % der Fälle wurde temporär eine Druckamplitude (driving pressure) von mehr als 15 mbar überschritten sowie in 20 % der Fälle ein FiO2 über 0,6 eingestellt. Eine Eskalation der Beatmungsdrücke wurde in der Regel beim Auftreten von bakteriellen Superinfektionen und damit einhergehenden septischen Verläufen notwendig. In einem Fall präsentierte sich ein rasant progredienter Verlauf des ARDS mit beatmungsrefraktärem Verlauf, sodass die Verlegung in ein externes Klinikum zur veno-venösen ECMO-Therapie indiziert war.
In Anbetracht der limitierten Fallzahl ist die Rate an beatmungsassoziierten Pneumothoraces in zwei Fällen recht hoch. In einem Fall kam es sogar zur Ausbildung eines Mediastinalemphysems. In der Literatur ist das Auftreten spontaner Pneumothoraxe oder eines Pneumomediastinums allenfalls in Einzelfallberichten oder vereinzelt in Autopsiestudien beschrieben worden [43][48][53].
Im Vergleich mit einer großen Kohorte intensivmedizinisch behandelter COVID-19Patienten (n=1 591) aus der Lombardei (Italien) zeigt sich ein medianer PEEP von 14 mbar mit Spitzenwerten bis 22 mbar, während der mediane PEEP in der vorliegenden Kohorte bei 15 mbar mit einem Maximalwert von 20 mbar liegt. In der italienischen Kohorte liegt das mediane FiO2 bei 0,7 und in der hier betrachteten Kohorte bei 0,55. Der mediane Oxygenierungsquotient nach Horovitz liegt bei 150 mmHg und in der Kohorte aus der Lombardei bei 160 mmHg [14]. Andere Autoren präsentieren mediane Horowitz-Quotienten von 136 mmHg (n = 138) bei einem medianen Erkrankungsalter von 56 Jahren [47].
Aufgrund der protrahierten Beatmungsdauer von 23,5 Tagen im Median in Kombination mit den bereits berichteten erhöhten Beatmungsdrücken ist von Volumen- oder Barotraumata sowie sekundären Biotraumata im Sinne ventilator-induzierter Lungenschädigungen (VILI) auszugehen [3][10]. Gleichzeitig erscheinen schwerwiegende mit COVID-19 assoziierte Langzeitfolgen im Sinne eines fibrotischen Lungengerüstumbaus in der Folge eines organisierenden Alveolarschadens als sehr wahrscheinlich. In der vorliegenden Studienpopulation konnten bereits computertomografisch beginnende Fibrosierungen des Lungengerüsts beschrieben werden. Das Langzeitergebnis nach überwundener SARS-CoV-2-Infektion bleibt hier abzuwarten. WU et al. konnten bei 84 retrospektiv erhobenen COVID-19-Patienten mit ARDS ein verbessertes Überleben durch die Applikation von Methylprednisolon beobachten [51]. Ein evidenzbasierter Vorteil durch die Gabe von Methylprednisolon im Hinblick auf die Reduktion von fibrotischen Lungengerüstveränderungen liegt aktuell nicht vor.
Die histopathologische Analyse der im Rahmen dieser Studie gewonnenen Gewebeproben bestätigte neben dem Nachweis eines diffusen alveolären Schadens (Diffuse Alveolar Damage, DAD) in unterschiedlichen Organisationsphasen einen beginnenden fibrotischen Lungengerüstumbau, wie es bereits in den zuvor angefertigten CT-Aufnahmen suspiziert wurde. Inzwischen publizierte Autopsie-Studien bestätigen dieses Ergebnis [1][26][53]. Das Auftreten eines DAD mit durch Epidermal Growth Factor Receptor (EGFR) getriggerter Fibroblastenaktivierung und konsekutiver pulmonaler Fibrose wurde bereits im Rahmen der SARS-Pandemie 2002 - 2003 beschrieben und wirft die Frage auf, inwieweit angesichts der hohen Fallzahlen im Rahmen der COVID-19-Pneumonie mit einem Anstieg fibrosierender Lungenerkrankungen als Folgeschaden zu rechnen ist [34][45]. Zum aktuellen Zeitpunkt ist noch unbekannt, ob auch mild verlaufende oder klinisch inapparente SARS-CoV-2-Infektionen zu einer langfristigen Einschränkung der Lungenfunktion führen können.
Der klinische Verlauf der beatmeten COVID-19-Patienten war durch eine schwierig umzusetzende Sedierung charakterisiert. Teilweise waren simultan vier Sedativa notwendig, um eine ausreichende Sedierungstiefe zu erreichen. In Ausnahmefällen war zeitweise eine Relaxierung notwendig, um eine ausreichende Oxygenierung der Patienten gewährleisten zu können. Die häufigste Indikation zur Eskalation der Sedierungstiefe war eine vorliegende Respirator-Asynchronität und eine bestehende Tachypnoe. Als möglicher pathophysiologischer Ansatz ist die vorbeschriebene Neuroinvasivität von SARS-CoV-2 zu diskutieren [29].
Als additive Therapieoptionen beim ARDS hat vor allem die Bauchlagerungstherapie ab einem Horowitz-Quotienten < 150 mmHg einen essenziellen Stellenwert [12][23]. In unserer Kohorte wurde beim Großteil der invasiv beatmeten Patienten (70 %, n = 7) frühzeitig (Horovitz-Quotient < 200 mmHg) eine Bauchlagerungstherapie durchgeführt. Eine Verbesserung der Oxygenierung und die damit einhergehende Möglichkeit der Beatmungsdeeskalation war in 71 % der Fälle (n = 5) möglich. In einem Fall ist es nach anfänglicher Verbesserung der Oxygenierung zu einem weiteren Krankheitsprogress mit Versagen der Bauchlagerungstherapie gekommen. Im Mittel erfolgten drei Bauchlagerungen (Wertespanne 1 - 6 Lagerungstherapien). In der von GRASSELLI et al. publizierten Kohorte wurden lediglich 27 % der Patienten einer Bauchlagerungstherapie zugeführt – ohne Angabe einer Erfolgsrate [14].
Die im Rahmen dieser Studie frühzeitig durchgeführte Bauchlagerungstherapie ab einem Horovitz-Quotienten von < 200 mmHg sorgte nicht dafür, dass ein vermehrtes Nichtansprechen auf diese Maßnahme verzeichnet wurde. Aufgrund der zu geringen Stichprobengröße kann abschließend keine allgemeine Empfehlung zum frühzeitigen Beginn einer Bauchlagerungstherapie ab einem Horovitz-Quotienten < 200 mmHg formuliert werden.
Klinische Konsequenz der Laborchemie
In Tabelle 3 sind die bei mit COVID-19 assoziiertem ARDS deutlich erhöhten Laborparameter Fibrinogen und D-Dimere aufgeführt und visualisiert. Trotz der laborchemisch detektierten prokoagulatorischen Komponente fehlten typische Merkmale einer disseminiert intravasalen Koagulopathie (DIC), wie beispielsweise eine Thrombozytopenie als Korrelat des Thrombozytenverbrauchs. Gleichzeitig kam es trotz der Applikation einer Thromboseprophylaxe mittels niedermolekularen Heparins (NMH) gehäuft zu thrombotischen und thromboembolischen Ereignissen (zwei katheterassoziierte Thrombosen, eine tiefe Beinvenenthrombose, eine Lungenarterienembolie). Aus der Literatur gehen vereinzelte Fallberichte einer fatalen Lungenarterienembolie hervor [26]. In der vorliegenden Kohorte ließ sich ein Todesfall auf eine Lungenarterienembolie zurückführen. Bereits für Influenzapneumonien konnten ACKERMANN et al. signifikant häufiger Mikroangiopathien und generalisierte Thrombosen in der Lungenstrombahn im Vergleich zu nicht viral bedingten ARDS-Formen detektieren [1]. Die auch in dieser Kohorte nachgewiesene Koagulopathie kann möglicherweise zur Erschwerung des ARDS und damit der Beatmungstherapie beigetragen haben, auch wenn ein histologischer Nachweis von ausgedehnten Gefäßthrombosen in der Lungenstrombahn nicht zu führen war. Eine generelle Empfehlung für eine therapeutische Antikoagulation oder ein intermediäres Konzept kann bislang nicht abschließend beurteilt werden [6][24]. Kontrastierend entwickelten sich in zwei Fällen Analfissuren mit konsekutiven schwerwiegenden Blutungsereignissen.
Das Auftreten eines ARDS bei COVID-19 ist mit einer ausgeprägten Akut-Phase-Reaktion und einer deutlichen Erhöhung von Inflammationsparametern assoziiert. Zudem besteht eine ausgeprägte Lymphozytopenie und Neutrophilie. Zahlreiche Autoren diskutieren ein durch Zytokinsturm getragenes Hyperinflammationssyndrom mit sekundärer Organdysfunktion. Es wird eine Erhöhung der Mediatoren IL-1, IL-2R, IL-6, IL-8, IL-10 TNF-α und Interferon-γ berichtet [18][27][32][41][52][54]. CHEN et al. fanden eine signifikante Korrelation mit dem Serumlevel des IL-2-Rezeptors sowie IL-6 und der Krankheitsschwere [5]. In einigen Fällen wird die Entstehung einer sekundären hämophagozytischen Lymphohistiozytose (sekHLH) vermutet.
Die HLH beschreibt ein schwerwiegendes Krankheitsbild, welches sich durch ausgeprägte Blutbildveränderungen, einer hochregulierten Akut-Phase-Reaktion einhergehend mit einer massiven Erhöhung des Serumferritins und einer Hypofibrinogenämie auszeichnet. Die HLH geht in der Regel mit dem Vorliegen eines Malignoms einher, wird durch virale Infektionen getriggert oder tritt im Rahmen einer Sepsis (3,7 - 4,3 % der Fälle) auf [32]. Neben den erhöhten Fibrinogenwerten der COVID-19-Patienten, erschien auch nach Erhebung des H-Scores das Vorliegen einer HLH unwahrscheinlich [11].
Eine bakterielle Superinfektion wurde in 55 % der Fälle vermutet und hatte den Beginn einer kalkulierten antibiotischen Therapie zur Folge. Ein Erregernachweis konnte allerdings nur in 17 % der Fälle erbracht werden. Der Stellenwert der zumeist empirisch begonnenen Antibiose ist aus vorliegendem Datensatz nicht abzuleiten. Bei geringer erfolgreicher Erreger-Kultivierungsrate und häufig schwieriger Differenzierung von einem Hyperinflammationssyndrom ist ein niedrigschwelliger Antibiotika-Einsatz kritisch zu beurteilen.
ARDS-Patienten zeigten im Vergleich zu nicht-ARDS-Patienten ein dezent höheres Troponin T. Multiple kardiale Rhythmusstörungen in Form eines intermittierenden Vorhofflatterns und zwischenzeitlichen Episoden einer höhergradigen atrioventrikulären (AV)-Blockierung traten in einem Fall auf. In bereits publizierten Kohorten wird das Auftreten von Arrhythmien zwischen 16,7 % und 44 % bei intensivmedizinisch betreuten Patienten beschrieben [30][47]. Als zugrunderliegender Pathomechanismus werden virale myokardiale Beteiligungen und koronare Mikroangiopathien bei kardial vorerkrankten Patienten diskutiert [16].
Eine krankheitsassoziierte akute Nierenschädigung (AKI) trat in zwei Fällen der vorliegenden Studienkohorte auf. PEI et al. diskutieren einen direkt nephrotoxischen Effekt von SARS-CoV-2. In Autopsiepräparaten zeigten sich akute Tubulusnekrosen ohne sichere Zeichen einer Glomerulonephritis oder einer interstitiellen Nephritis [36]. Gleichzeitig beschreiben RONCO et al. eine Nierenschädigung, die entweder durch eine direkte Zytokinläsion oder im Rahmen eines sekundären kardiorenalen Syndroms (Typ I) auftritt. Ursache des kardiorenalen Syndroms könnte die bereits diskutierte virale Myokarditis sein. Zusätzlich wird eine medulläre Hypoxie im Rahmen des ARDS als möglicher pathophysiologischer Ansatz in Betracht gezogen [38]. Die im Median normwertigen Nierenretentionsparameter aller Subgruppen der vorliegenden Kohorte können aufgrund der geringen Stichprobengröße über eine insgesamt häufige Nierenbeteiligung bei COVID-19 hinwegtäuschen.
Limitationen
Limitationen der vorliegenden Studie sind die geringe Patientenanzahl, die fehlende Randomisierung der Patienten und nicht vollständig auszuschließende statistische Verzerrungen durch die Übernahme von fünf intensivmedizinisch vorbehandelten und invasiv beatmeten Patienten aus dem umliegenden Ausland (23 %).
Fazit
Bei schweren Verläufen von COVID-19 handelt es sich um eine Systemerkrankung, welche neben einem in der Beatmungstherapie anspruchsvollen ARDS zusätzlich unterschiedliche Organmanifestationen aufweisen kann, die das therapeutische Management dieser Patienten erheblich erschweren. Durch die systemische Beteiligung der SARS-CoV-2-Infektion wird der Krankheitsverlauf von regelmäßigen Komplikationen überschattet. Dadurch werden aggressive Beatmungseinstellungen mit daraus resultierenden ventilator-induzierten Lungenschädigungen notwendig. Eine eindeutige Diskrimination hinsichtlich einer direkt viralen Schädigung und Effekten einer Hyperinflammation im Sinne eines Zytokinsturms ist bislang nur bedingt möglich. Insgesamt erfordert die Betreuung von COVID-19-Patienten mit moderat bis schwerem ARDS ein höchst individuelles Beatmungsmanagement mit engmaschiger Evaluation der Parametereinstellungen.
Weiterhin unklar erscheint der Stellenwert einer frühzeitigen antibiotischen Therapie bei vermuteter bakterieller Superinfektion und ausbleibendem Erregernachweis sowie der Stellenwert der Antikoagulation. Die Evidenz von antiviralen Substanzen (z. B. Remdesivir) oder immunmodulierenden bzw. -suppressiven Substanzen (z. B. Tocilizumab), um Zytokinstürme möglicherweise zu kontrollieren, bleibt vor allem im Hinblick auf die langfristige Erkrankungsprognose abzuwarten. Von besonderem Interesse wird die Fragestellung sein, zu welchem Zeitpunkt immunsupprimierende oder antifibrotische Substanzen eingesetzt werden sollten, um fibrotische Lungengerüstveränderungen, die sich bereits während der aktiven Erkrankung abzeichnen, abwenden zu können.
Literatur
- Ackermann M, Verleden SE, Kuehnel M et al.: Pulmonary Vascular Endothelialitis, Thrombosis, and Angiogenesis in Covid-19. N Engl J Med 2020; 383(2): 120-128. mehr lesen
- Atri D, Siddiqi HK, Lang J et al.: COVID-19 for the Cardiologist: A Current Review of the Virology, Clinical Epidemiology, Cardiac and Other Clinical Manifestations and Potential Therapeutic Strategies. JACC Basic Transl Sci 2020; 5(5): 518-536. mehr lesen
- Beitler JR, Malhotra A, Thompson BT: Ventilator-induced Lung Injury. Clin Chest Med. 2016; 37(4): 633-646. mehr lesen
- Carsana L, Sonzogni A, Nasr A, et al.: Pulmonary post-mortem findings in a series of COVID-19 cases from northern Italy: a two-centre descriptive study. The Lancet Infectious Diseases. 2020 mehr lesen
- Chen L, Liu H, Liu W et al.: Analysis of clinical features of 29 patients with 2019 novel coronavirus pneumonia. Zhonghua Jie He He Hu Xi Za Zhi 2020; 43(0): E005-E005. mehr lesen
- Connors JM, Levy JH: COVID-19 and its implications for thrombosis and anticoagulation. Blood 2020; 135(23): 2033-2040.. mehr lesen
- Cook TM, El-Boghdadly K, McGuire B et al.: Consensus guidelines for managing the airway in patients with COVID-19: Guidelines from the Difficult Airway Society, the Association of Anaesthetists the Intensive Care Society, the Faculty of Intensive Care Medicine and the Royal College of Anaesthetists. Anaesthesia 2020; 75(6): 785-799. mehr lesen
- Cucinotta D, Vanelli M: WHO Declares COVID-19 a Pandemic. Acta Biomed 2020; 91(1): 157-160. mehr lesen
- Dolhnikoff M, Duarte-Neto AN, de Almeida Monteiro RA et al.: Pathological evidence of pulmonary thrombotic phenomena in severe COVID-19. J Thromb Haemost 2020; 10.1111/jth. 14844 [Epub ahead of print]. mehr lesen
- Fan E, Brodie D, Slutsky AS: Acute Respiratory Distress Syndrome: Advances in Diagnosis and Treatment. Jama 2018; 319(7): 698-710. mehr lesen
- Fardet L, Galicier L, Lambotte O et al.: Development and validation of the HScore, a score for the diagnosis of reactive hemophagocytic syndrome. Arthritis & Rheumatology. 2014; 66(9): 2613-2620. mehr lesen
- Fichtner F, Moerer O, Laudi S et al.:Mechanical Ventilation and Extracorporeal Membrane Oxygena tion in Acute Respiratory Insufficiency. Dtsch Arztebl Int 2018; 115(50): 840-847. mehr lesen
- Fung S-Y, Yuen K-S, Ye Z-W, Chan C-P, Jin D-Y: A tug-of-war between severe acute respiratory syndrome coronavirus 2 and host antiviral defence: lessons from other pathogenic viruses. Emerging microbes & infections 2020; 9(1): 558-570. mehr lesen
- Grasselli G, Zangrillo A, Zanella A, et al.: Baseline Characteristics and Outcomes of 1591 Patients Infected With SARS-CoV-2 Admitted to ICUs of the Lombardy Region, Italy. Jama 2020; 323(16): 1574-1581. mehr lesen
- Guo YR, Cao QD, Hong ZS et al.: The origin, transmission and clinical therapies on coronavirus disease 2019 (COVID-19) outbreak - an update on the status. Mil Med Res 2020; 7(1): 11. mehr lesen
- Guzik TJ, Mohiddin SA, Dimarco A et al.: COVID-19 and the cardiovascular system: implications for risk assessment, diagnosis, and treatment options. Cardiovasc Res 2020; cvaa106 [Published online]. mehr lesen
- Hecker M, Seeger W, Mayer K: Die Berlin-Definition. Medizinische Klinik-Intensivmedizin und Notfallmedizin 2012; 107(6): 488-490.
- Henderson LA, Canna SW, Schulert GS et al.: On the Alert for Cytokine Storm: Immunopathology in COVID-19. Arthritis Rheumatol 2020; 72(7): 1059-1063. mehr lesen
- Hoffmann M, Kleine-Weber H, Schroeder S et al.: SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell. 2020; 181(2): 271-280.e8. mehr lesen
- Hopkins C, Surda P, Kumar N: Presentation of new onset anosmia during the COVID-19 pandemic. Rhinology 2020; 58(3): 295-298. mehr lesen
- Kakodkar P, Kaka N, Baig MN: A Comprehensive Literature Review on the Clinical Presentation, and Management of the Pandemic Coronavirus Disease 2019 (COVID-19). Cureus 2020; 12(4): e7560. mehr lesen
- Klopfenstein T, Kadiane-Oussou NJ, Toko L et al.: Features of anosmia in COVID-19. Med Mal Infect 2020; 50(5): 436-439. mehr lesen
- Kluge S, Janssens U, Welte T et al.: [Recommendations for critically ill patients with COVID-19]. Med Klin Intensivmed Notfmed. 2020; 115(3): 175-177. mehr lesen
- Kollias A, Kyriakoulis KG, Dimakakos E et al.: Thromboembolic risk and anticoagulant therapy in COVID-19 patients: emerging evidence and call for action. Br J Haematol 2020; 189(5); 846-847. mehr lesen
- Lai CC, Shih TP, Ko WC, Tang HJ, Hsueh PR: Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) and coronavirus disease-2019 (COVID-19): The epidemic and the challenges. Int J Antimicrob Agents 2020; 55(3): 105924. mehr lesen
- Lax SF, Skok K, Zechner P et al.: Pulmonary Arterial Thrombosis in COVID-19 With Fatal Outcome: Results From a Prospective, Single-Center, Clinicopathologic Case Series. Ann Intern Med 2020; M20-2566. mehr lesen
- Li H, Liu L, Zhang D et al.: SARS-CoV-2 and viral sepsis: observations and hypotheses. Lancet 2020; 395(10235): 1517-1520. mehr lesen
- Li Y, Xia L: Coronavirus Disease 2019 (COVID-19): Role of Chest CT in Diagnosis and Management. AJR Am J Roentgenol. 2020; 214(6): 1280-1286. mehr lesen
- Li YC, Bai WZ, Hashikawa T: The neuroinvasive potential of SARS-CoV2 may play a role in the respiratory failure of COVID-19 patients. J Med Virol 2020; 10.1002/jmv.25728 [Epub ahead of print]. mehr lesen
- Liu K, Fang YY, Deng Y et al.: Clinical characteristics of novel coronavirus cases in tertiary hospitals in Hubei Province. Chin Med J (Engl) 2020; 133(9): 1025-1031. mehr lesen
- Liu PP, Blet A, Smyth D, Li H: The Science Underlying COVID-19: Implications for the Cardiovascular System. Circulation 2020; 142: 68-78. mehr lesen
- Mehta P, McAuley DF, Brown M et al.: COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet 2020; 395(10229): 1033-1034. mehr lesen
- Murray JF, Matthay MA, Luce JM, Flick MR: An expanded definition of the adult respiratory distress syndrome. Am Rev Respir Dis 1988; 138(3): 720-723. mehr lesen
- Nicholls J, Dong XP, Jiang G, Peiris M: SARS: clinical virology and pathogenesis. Respirology 2003; 8(Suppl 1): S6-S8. mehr lesen
- Pan Y, Zhang D, Yang P, Poon LLM, Wang Q. Viral load of SARS-CoV-2 in clinical samples. Lancet Infect Dis. 2020; 20(4): 411-412. mehr lesen
- Pei G, Zhang Z, Peng J et al.: Renal Involvement and Early Prognosis in Patients with COVID-19 Pneumonia. J Am Soc Nephrol 2020; mehr lesen
- Rodriguez-Morales AJ, Cardona-Ospina JA, Gutiérrez-Ocampo E et al.: Clinical, laboratory and imaging features of COVID-19: A systematic review and meta-analysis. Travel Med Infect Dis 2020; 34: 101623. mehr lesen
- Ronco C, Reis T: Kidney involvement in COVID-19 and rationale for extracorporeal therapies. Nat Rev Nephrol 2020: 16(6): 308-310. mehr lesen
- Rothan HA, Byrareddy SN: The epidemiology and pathogenesis of coronavirus disease (COVID-19) outbreak. J Autoimmun 2020; 109: 102433. mehr lesen
- Shereen MA, Khan S, Kazmi A, Bashir N, Siddique R: COVID-19 infection: Origin, transmission, and characteristics of human coronaviruses. J Adv Res 2020; 24: 91-98. mehr lesen
- Siddiqi HK, Mehra MR: COVID-19 illness in native and immunosuppressed states: A clinical-therapeutic staging proposal. J Heart Lung Transplant 2020; 39(5): 405-407. mehr lesen
- Simpson S, Kay FU, Abbara S et al.: Radiological Society of North America Expert Consensus Statement on Reporting Chest CT Findings Related to COVID-19. Endorsed by the Society of Thoracic Radiology, the American College of Radiology, and RSNA. Radiology: Cardiothoracic Imaging 2020; 2(2): e200152. mehr lesen
- Sun R, Liu H, Wang X: Mediastinal Emphysema, Giant Bulla, and Pneumothorax Developed during the Course of COVID-19 Pneumonia. Korean J Radiol 2020; 21(5): 541-544. mehr lesen
- Vaira LA, Salzano G, Deiana G, De Riu G. Anosmia and Ageusia: Common Findings in COVID-19 Patients. Laryngoscope 2020; 130(7): 1787. mehr lesen
- Venkataraman T, Frieman MB: The role of epidermal growth factor receptor (EGFR) signaling in SARS coronavirus-induced pulmonary fibrosis. Antiviral Res 2017; 143: 142-150. mehr lesen
- Wan Y, Shang J, Graham R, Baric RS, Li F: Receptor Recognition by the Novel Coronavirus from Wuhan: an Analysis Based on Decade-Long Structural Studies of SARS Coronavirus. Journal of Virology 2020; 94(7): e00127-20. mehr lesen
- Wang D, Hu B, Hu C et al.: Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. Jama 2020; 323(11): 1061-1069. mehr lesen
- Wang W, Gao R, Zheng Y, Jiang L: COVID-19 with spontaneous pneumothorax,pneumomediastinum and subcutaneous emphysema. J Travel Med 2020; taaa062 [Online ahead of print]. mehr lesen
- Wang Y, Wang Y, Chen Y, Qin Q: Unique epidemiological and clinical features of the emerging 2019 novel coronavirus pneumonia (COVID-19) implicate special control measures. J Med Virol 2020; 92(6): 568-576. mehr lesen
- Weaver LK, Behrens EM: Weathering the storm: Improving therapeutic interventions for cytokine storm syndromes by targeting disease pathogenesis. Curr Treatm Opt Rheumatol 2017; 3(1): 33-48. mehr lesen
- Wu C, Chen X, Cai Y et al.: Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Intern Med 2020; 180(7): 1-11. mehr lesen
- Wu D, Yang XO: TH17 responses in cytokine storm of COVID-19: An emerging target of JAK2 inhibitor Fedratinib. J Microbiol Immunol Infect 2020; 53(3): 368-370. mehr lesen
- Yang F, Shi S, Zhu J et al.: Analysis of 92 deceased patients with COVID-19. J Med Virol 2020; 10.1002/jmv.25891 [Online ahead of print]. mehr lesen
- Ye Q, Wang B, Mao J: The pathogenesis and treatment of the `Cytokine Storm' in COVID-19. J Infect 2020; 80(6): 607-613. mehr lesen
- Zhong Z, Hu Y, Yu Q et al.: Multistage CT features of coronavirus disease 2019. Zhong Nan Da Xue Xue Bao Yi Xue Ban 2020; 45(3): 250-256. mehr lesen
- Zhou F, Yu T, Du R et al.: Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet 2020; 395(10229): 1054-1062. mehr lesen
- Zhou M, Zhang X, Qu J: Coronavirus disease 2019 (COVID-19): a clinical update. Front Med 2020; 14(2): 126-135. mehr lesen
- Zhu J, Ji P, Pang J et al.: Clinical characteristics of 3,062 COVID-19 patients: a meta-analysis. J Med Virol 2020; 10.1002/jmv.25884 [Online ahead of print]. mehr lesen
Interessenkonflikt
Die Verfasser erklären, dass kein Interessenkonflikt im Sinne der Richtlinien des International Committee of Medical Journal Editors besteht.
Manuskriptdaten
Eingereicht: 30. Juni 2020
Nach Überarbeitung angenommen: 30. Juli 2020
Zitierweise
Rother C, Richter B, Keilholz D, Bauer J, Umathum VG, Hackenbroch C, Opderbeck S, Burbach M, Gagiannis M, Steinestel K, Witte HM: COVID-19 – klinisch-pathologische Charakteristika von Patienten mit SARS-CoV-2-assoziiertem respiratorischen Versagen (ARDS). WMM 2020; 64(9): e20.
Für die Verfasser
Oberstabsarzt Hanno M. Witte
Bundeswehrkrankenhaus Ulm
Klinik für Innere Medizin
Oberer Eselsberg 40, 89081 Ulm
E-Mail: hannowitte@bundeswehr.org
Manuscript data
Submitted: 30 June 2020
Accepted after minor revision: 30 July 2020
Citation
Rother C, Richter B, Keilholz D, Bauer J, Umathum VG, Hackenbroch C, Opderbeck S, Burbach M, Gagiannis M, Steinestel K, Witte HM: COVID-19 – clinicopathological characteristics of patients with SARS-CoV-2 related ARDS.WMM 2020; 64(9): e20.
For the authors
Major (MC) Hanno M. Witte
Bundeswehr Hospital Ulm
Department for Internal Medicine
Oberer Eselsberg 40, D-89081 Ulm
E-Mail: hannowitte@bundeswehr.org
1 Beiträge der Autoren: Studienkonzept: Richter, Rother, Witte; Datenerfassung: Rother, Umathum, Burbach, Witte;
Datenanalyse und Erstellung von Tabellen und Abbildungen: Rother, Richter, Steinestel, Witte;
Erstfassung des Manuskripts: Rother, Richter, Steinestel, Witte;
Korrektur des Manuskripts: alle Autoren.
Rother und Richter trugen zu gleichen Anteilen zur Entstehung des Manuskripts bei.
Appendix
Appendix Tab. 1: Auswärtig initiierte antivirale Therapieversuche in der vorliegenden Studienkohorte.
Appendix Tab. 2: Eingesetzte antibiotische Regime bei suspizierter bakterieller Superinfektion.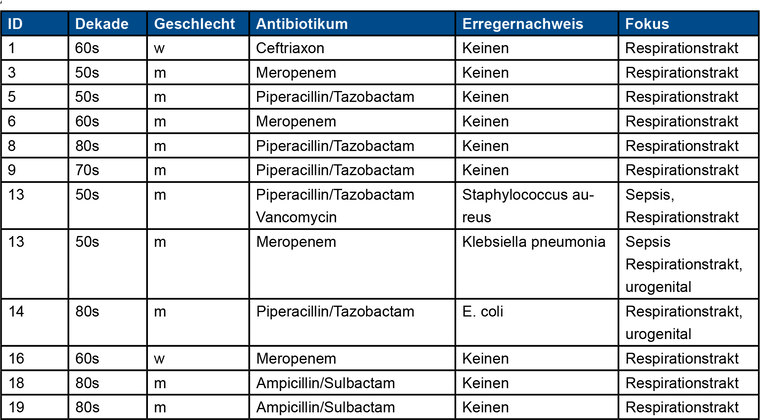
Abkürzungen
ACE-2: angiotensin converting enzyme 2
aPTT: aktiviere partielle Thromboplastinzeit
ARDS: acute respiratory distress syndrome
BiPAP: biphasic positive airway pressure
CFR: case fatality rate
CPAP: continuous positive airway pressure
CRP: C-reaktives Protein
CT: Computer Tomographie
CVVHDF: continuous venovenous hemodiafiltration
DAD: diffuse alveolar damage
DP: driving pressure
ECMO: extracorporal membrane oxygenation
EGFR: epidermal growth receptor factor receptor
KI: Konfidenzintervall
FiO2: fraction inspired oxygen
KG: Körpergewicht
IL-6: Interleukin-6
IST: Intensivstation
INR: international normalized ratio
LDH: Laktatdehydrogenase
mbar: Millibar
PEEP: positive endexpiratory pressure
Pinsp: Inspriratorischer Druck
Ppeak: maximaler Inspirationsdruck
RT-PCR: Real-Time-PCR
VAP: Ventilator assoziierte Pneumonie
VT: Tidalvolumen