
KASUISTIKEN
Neurologische Manifestationen bei SARS-CoV-2-
Infektion und intensivpflichtigen COVID-19-Patienten
Neurological manifestations in SARS-CoV-2 infection and intensive care
patients with COVID-19
Alexander Sigla, Patrick Heinza, Monika Meistera, Andreas Hartha, Jens Metrikata
a Bundeswehrkrankenhaus Ulm, Klinik für Neurologie
Zusammenfassung
Seit dem Ausbrechen der Infektion mit dem Servere Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Ende 2019, von dem auch die Bundeswehrkrankenhäuser betroffen sind, häufen sich Berichte über neurologische Manifestationen im Rahmen der Pandemie. Wir nehmen Einzelfälle von COVID-19-Patienten am Bundeswehrkrankenhaus Ulm zum Anlass, wehrmedizinisch relevante neurologische Aspekte der aktuellen Literatur mit Stand bis Juli 2020 darzustellen.
Neurologische Manifestationen betreffen sowohl das periphere (z. B. Guillain-Barré-Syndrom), als auch das zentrale Nervensystem (z. B. Schlaganfall oder Enzephalopathie). Bei drei COVID-19-Patienten traten neurologische Auffälligkeiten während der intensivmedizinischen Behandlung im Bundeswehrkrankenhaus Ulm auf, bei einem SARS-CoV-2 positivem Patienten während der Behandlung auf der Stroke Unit. Eine Unterscheidung zwischen spezifischen Folgen der Virusinfektion und bekannten Folgen eines intensivmedizinischen Aufenthalts von kritisch Kranken erweist sich zum aktuellen Zeitpunkt als herausfordernd.
Wichtig ist die Erkenntnis, dass COVID-19-Patienten auch neurologische Symptome entwickeln können. Umgekehrt sollte bei Patienten mit neurologischen Symptomen auch eine SARS-CoV-2-Infektion als mögliche Ursache berücksichtigt werden.
Neurologische Komplikationen im Zuge einer intensivmedizinischen Behandlung von COVID-19 Patienten bedürfen einer fachneurologischen Expertise mit Berücksichtigung langfristiger neurorehabilitativer Aspekte.
Schlüsselwörter: COVID-19, SARS-CoV-2, Neurologie, Anosmie, Enzephalopathie, cerebrovaskuläre Erkrankungen, Guillain-Barré-Syndrom, Intensivpatienten
Summary
Since the onset of the first infection with the Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) at the end of 2019, which also affects the Bundeswehr hospitals in Germany, reports of neurological manifestations in the context of the pandemic have been increasing. We take individual cases of COVID-19 patients treated at the Bundeswehr Hospital Ulm as an opportunity to present neurological, military-related aspects of the current literature as of July 2020.
Neurological manifestations affect both the peripheral (e.g. Guillain-Barré syndrome) and the central nervous system (e.g. stroke or encephalopathy). Three patients with Coronavirus Disease 2019 (COVID-19) had neurological complications during intensive care (ICU) and one SARS-CoV-2 positive patient on our stroke unit at the Bundeswehr Hospital Ulm. A distinction between the specific consequences of viral infection and known consequences of critical ill patients on ICU is proving challenging at this time.
It is important to recognize that COVID-19 patients can also develop neurological symptoms, as well as to consider SARS-CoV-2 infection as a possible cause in patients with neurological symptoms.
Neurological complications in the course of intensive medical treatment of COVID-19 patients require a neurological expertise with consideration of long-term neurorehabilitative aspects.
Keywords: COVID-19, SARS-CoV-2, neurology, anosmia, encephalopathy, cerebrovascular disease, Guillain-Barre syndrome, critical care patients
Hintergrund
Im Laufe der vergangenen Monate kam es zu einer Häufung von Fallberichten, Studien und Reviews über neurologische Manifestationen im Rahmen der Servere Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Pandemie.
Infektionen des Nervensystems durch sogenannte neurotrope Viren sind nicht nicht selten (z. B. Meningitis und Enzephalitis durch FSME, Varizella-Zoster-, Herpes-simplex- oder Enteroviren) und auch besonders relevant in den Einsatzländern der Bundeswehr (z. B. Enzephalopathie durch in Mali endemische Lassa-Viren [15]). Nicht zuletzt sind auch Einsatzländer und somit die dort eingesetzten Soldatinnen und Soldaten durch die aktuelle SARS-CoV-2-Pandemie betroffen.
Die neurologischen Komplikationen im Rahmen einer SARS-CoV-2-Infektion betreffen sowohl das zentrale als auch das periphere Nervensystem – mit wohl unterschiedlichen zugrundeliegenden Pathomechanismen. Bei Intensivpatienten ohne COVID-19 sind bereits zahlreiche, teils schwerwiegende neurologische Komplikationen bekannt. Eine Unterscheidung zwischen spezifischen Folgen der Virusinfektion und unspezifischen Folgen eines intensivmedizinischen Aufenthalts mit unterschiedlichen Begleiterkrankungen erweist sich zum aktuellen Zeitpunkt als herausfordernd und bedarf weiterer Untersuchungen.
Eine neurologische Mitbeteiligung nach einer SARS-CoV-2-Infektion bzw. nach einem intensivmedizinischen Aufenthalt kann zu einer dauerhaften schweren körperlichen und geistigen Behinderung führen. Akutbehandlung bis neurorehabilitative Maßnahmen verfolgen das Ziel eines möglichst guten Behandlungsergebnisses dieser Patienten.
Fall-Synopsen
Fall 1
68-jähriger, männlicher, französischer, intensivpflichtiger Patient, mit bestätigter superinfizierter COVID-19-Pneumonie:
- Klinisch-neurologische Untersuchung mit ausgeprägter proximal betonter Parese und Muskelatrophie; Muskeldehnungsreflexe seitengleich mittellebhaft erhalten
- Neurophysiologische Untersuchung ohne Anzeichen für eine Neuropathie
- Elektromyographie: Keine ableitbare Willküraktivität; im Musculus tibialis anterior positive scharfe Wellen als Zeichen pathologischer Spontanaktivität
Verdachtsdiagnose
Hochgradiger klinischer Verdacht auf eine Critical Illness Myopathie (CIM).
Fall 2
78-jähriger, männlicher, deutscher, intensivpflichtiger Patient mit akutem Atemnotsyndrom bei bestätigter COVID-19-Pneumonie:
- Klinisch-neurologische Untersuchung mit delirantem Syndrom; allseits reduzierte Muskeldehnungsreflexe, beidseits nicht erhältlicher Achillessehnen-Reflex, Sensibilität nicht adäquat beurteilbar
- Neurophysiologische Diagnostik mit Hinweisen auf eine symmetrische, distal betonte, sensomotorische Polyneuropathie, führend mit verminderten Nervenleitgeschwindigkeiten, insbesondere im Nervus peroneus und Nervus tibialis
Diagnose
Passageres Delir und Verdacht auf eine Critical Illness Polyneuropathie (CIP).
Fall 3
66-jährige, weibliche, deutsche, intensivpflichtige Patientin mit akutem Atemnotsyndrom bei bestätigter COVID-19-Pneumonie:
- Klinisch-neurologische Untersuchung mit gestörtem Schluckvorgang und Schwäche der Zungenmuskulatur, daneben generalisierte Muskelatrophie, leichtgradige Tetraparese und prolongiertes Weaning
- Neurophysiologische Untersuchung ohne wegweisenden Befund, keine invasive Elektromyographie und Biopsie aufgrund von Antikoagulation.
Diagnose
Differenzialdiagnostischer Verdacht auf eine Critical Illness Myopathie (CIM).
Fall 4
64-jähriger, männlicher, türkischer Stroke-Unit-Patient, respiratorisch-asymptomatisch bei bestätigter SARS-CoV-2-Infektion:
- akut aufgetretene Hemiparese links, afebril, pulmonal unauffällig
- Bildgebung: Verschluss der rechten A. cerebri media mit großer Penumbra im Mediastromgebiet rechts
- Verlauf: Systemische Thrombolyse, frustrane Aspirationsthrombektomie, Mikrostent-Einlage mit kompletter Rekanalisation, Regredienz der Hemiparese.
Nach sieben Tagen erneut hochgradige Hemiparese links bei Nachweis eines In-Stent-Verschlusses trotz dualer Thrombozytenaggregationshemmung.
Diagnose
Rezidivierender ischämischer Schlaganfall mit Verdacht auf Hyperkoagulopathie im Rahmen einer SARS-CoV-2-Infektion
Neurologische Manifestationen bei
SARS-CoV-2-Infektion
Neurologische Manifestationen im Rahmen der SARS-CoV-2-Infektion können sowohl Gehirn und Rückenmark, also das zentrale Nervensystem (ZNS), als auch das periphere Nervensystem (PNS) mit Gefäß- und Muskelbeteiligung betreffen. Abbildungen 1 und 2 geben einen Überblick über publizierte neurologische Manifestationen bei COVID-19-Patienten [44][48].

Abb. 1: Periphernervöse/muskuläre Manifestationen bei COVID-19 in Anlehnung an ROMAN et al. und PATERSON et al. [44][48]
Pathophysiologie neurologischer Manifestationen durch SARS- CoV-2
Als mögliche Eintrittspforte des SARS-CoV-2 gelten die Riechnerven (N. olfactorius, 1. Hirnnerv) bzw. der mit ihnen verbundene Bulbus olfactorius, welcher als einziger Teil des ZNS nicht von Dura mater geschützt ist [21]. Der Transport von Viren über eine gestörte Blut-Hirnschranke via infizierter Leukozyten wird ebenfalls als möglicher Infektionsweg des ZNS diskutiert [17].
Im Endothel von cerebralen Gefäßen konnten zudem Angiotensin converting enzyme 2 (ACE2)-Rezeptoren nachgewiesen werden [28], an die SARS-CoV-2 bindet, um in die Zelle zu gelangen [71]. Nach Bindung an den ACE2-Rezeptor löst das Virus eine Zytokinausschüttung aus, mit einem deutlichen Anstieg von Interleukin-1, Interleukin-6 und Tumornekrosefaktor [38][68]. Hohe Level dieser Zytokine steigern die vaskuläre Permeabilität und führen zu einer inflammatorisch bedingten Schädigung multipler Organe inklusive des ZNS [56]. Der Zytokinsturm triggert ebenfalls hyperkoagulatorische Kaskaden, die Blutgerinnsel in kleinen und großen Gefäßen verursachen können [23][68] (siehe Abbildung 3).

Abb. 2: Zentralnervöse Manifestationen bei COVID-19 in Anlehnung an ROMAN et al. und PATERSON et al. [44][48]
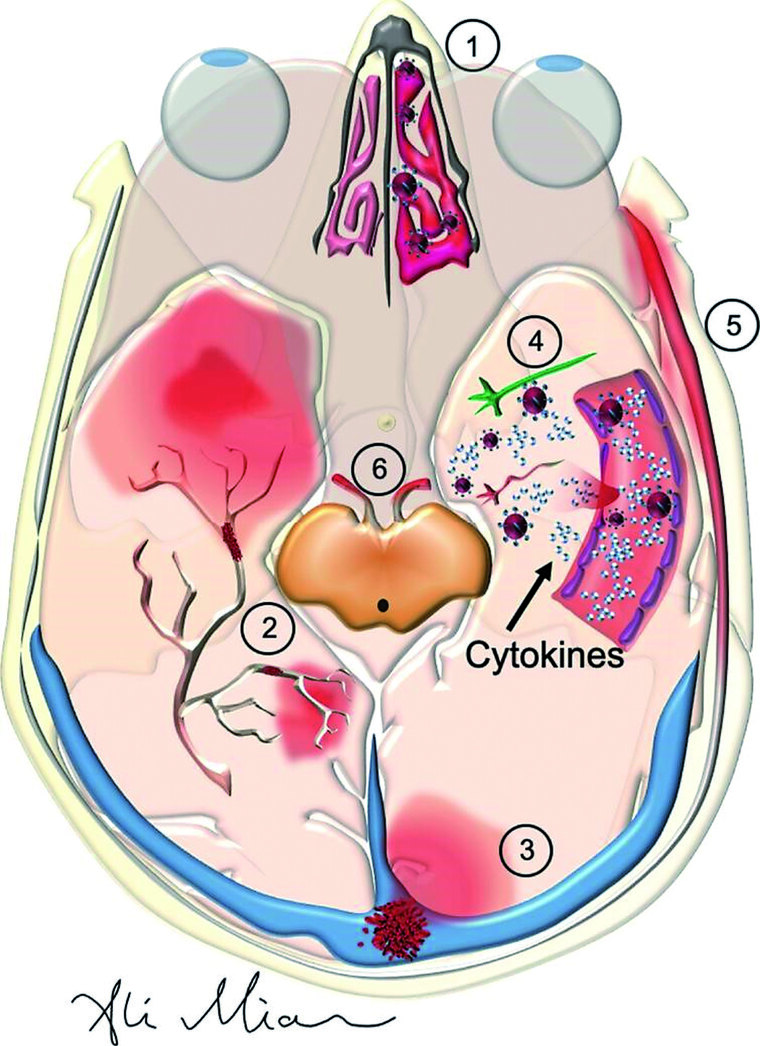
Abb. 3: Pathophysiologisches Modell der ZNS-Beteiligung bei SARS-CoV-2-Infektion (aus M. FOTUHI et al., [23]):
(1) Bindung und Inhibition von nasalen epithelialen Zellen mit Hyposmie
(2) Aktivierung inflammatorischer und thrombogener Signalwege mit Okklusion cerebraler Gefäße
(3) Sinus- bzw. Hirnvenenthrombose
(4) Hohe Zytokinlevel in den cerebralen Gefäßen können zu einer Schädigung der Blut-Hirn-Schranke führen, mit Infektion des Hirngewebes im Sinne einer Enzephalitis
(5) Schädigung meningealer Gefäße kann zu einer Meningitis führen
(6) Schädigung von Hirnnerven durch Autoantikörper
Durch SARS-CoV-2 bewirkte neurologische Manifestationen können nach FUTOHI et al. [23] in drei Stadien entsprechend der Stärke der viralen Infektion und Zytokinfreisetzung eingeteilt werden (Abbildung 4).

Abb. 4: NeuroCovid Stadien I bis III nach FUTOHI et al. [23]
Riech- und Geschmacksstörungen
Zu den besonders häufig berichteten neurologischen Manifestationen im Rahmen von COVID-19 zählen Hyposmie/Anosmie und Hypogeusie/Ageusie. Die Prävalenz von olfaktorischen bzw. gustatorischen Störungen unter COVID-19-Patienten wird mit ca. 80-90 % beziffert [32]. Beeinträchtigungen der olfaktorischen und gustatorischen Funktion bei COVID-19-Patienten treten wahrscheinlich durch eine Infektion der epithelialen Zellen der oralen und nasalen Mucosa durch das Virus auf [32][60]. In den olfaktorischen epithelialen Zellen, dem Nasopharynx und der oralen Mucosa, besteht eine hohe Dichte an ACE2-Rezeptoren [58][69]. Durch Bindung an die ACE2-Rezeptoren in der nasalen und oralen Mucosa kann SARS-CoV-2 sensorisch-rezeptive Zellen inhibieren und so zu einem vermindertem Geruchs- und Geschmacksempfinden führen [23].
Cerebrovaskuläre Erkrankungen
Unter cerebrovaskulären Erkrankungen werden hier ischämische und hämorrhagische Schlaganfälle sowie Sinus- bzw. Hirnvenenthrombosen zusammengefasst. In mehreren Studien bzw. Fallserien wurde über cerebrovaskuläre Ereignisse bei COVID-19 Patienten berichtet. In einer Studie von LI et al. wurde bei 13 von 221 COVID-19 Patienten bildgebend eine cerebrovaskuläre Erkrankung festgestellt. Die meisten Patienten erlitten dabei einen ischämischen Schlaganfall [34]. In einer Fallserie aus New York wurde über fünf junge COVID-19-Patienten unter 50 Jahren berichtet, die innerhalb kurzer Zeit mit ischämischen Territorialinfarkten vorstellig wurden. Zwei dieser fünf Patienten hatten keinerlei kardiovaskuläre Risikofaktoren zum Zeitpunkt des Schlaganfalls [42].
In einer retrospektiven Studie aus New York mit ca. 3 400 Patienten wurde die Inzidenz von ischämischen Schlaganfällen unter COVID-19-Patienten mit der von Influenzapatienten verglichen [39]. Notfallmäßig bzw. stationär behandelte Influenzapatienten wiesen eine Schlaganfallrate von 0,2% auf. Demgegenüber hatten COVID-Patienten mit 1,6 % deutlich häufiger einen ischämischen Schlaganfall (Odds ratio 7,6; 95%-Konfidenzintervall, 2,3-25,2).
In einer weiteren Studie mit ca. 3500 COVID-19-Patienten wurde deutlich, dass insbesondere jüngere Männer von einem ischämischen Schlaganfall betroffen sind [70]. Außerdem ging der Schlaganfall bei COVID-19-Patienten mit einem schwerwiegenderen neurologischen Defizit und einer deutlich höheren Mortalität als bei hospitalisierten Patienten ohne COVID-19 einher (64 % vs. 6%; p<0.001).
Es gibt Hinweise dafür, dass COVID-19 Patienten ein erhöhtes Risiko für die Entwicklung hyperkoagulatorischer Zustände haben [56]. Blutgerinnsel können dabei sowohl im arteriellen als auch im venösen System auftreten [7][35]. Das im Zusammenhang mit einer SARS-CoV-2-Infektion beschriebene erhöhte Risiko für ischämische Schlaganfälle wurde in der Vergangenheit allgemeingültiger in großen bevölkerungsbasierten Studien für verschiedene virale und bakterielle Infektionen aufgezeigt [43]. Eine mögliche Ursache cerebrovaskulärer Erkrankungen im Rahmen einer SARS-CoV-2 Infektion stellt die Schädigung endothelialer Zellen durch das Virus dar. Dies führt zu einer Aktivierung von inflammatorischen und thrombogenen Signalwegen [62].
Enzephalitis, Meningitis und Enzephalopathie
Eine Enzephalitis bezeichnet die Entzündung des Hirnparenchyms, verursacht durch eine Infektion oder durch das körpereigene Immunsystem. Einzelfallberichte schildern COVID-19-Patienten im Alter von 24 bis 78 Jahren mit einer Enzephalitis [11][20][40][45][54][64][65]. Die neurologischen Auffälligkeiten traten von Tag 0 bis 17 nach Beginn der respiratorischen Symptome auf. Zwei Patienten hatten lediglich Fieber ohne respiratorische Symptome [20][64]. In den Fallberichten wurden typische neurologische Manifestationen einer Enzephalitis beschrieben mit Verwirrtheit, Reizbarkeit und Vigilanzminderung, teilweise assoziiert mit epileptischen Anfällen. Drei Patienten präsentierten sich mit einer Nackensteifigkeit [20][40][45]. Eine Liquordiagnostik wurde bei sechs Fällen beschrieben, von denen fünf eine primär lymphozytäre Pleozytose als Ausdruck der viral-entzündlichen Reaktion zeigten. In der MRT-Bildgebung konnten bei zwei Patienten Hyperintensitäten festgestellt werden. Eine bei fünf Patienten durchgeführte Elektroenzephalographie (EEG) [11][20][45][54][64] zeigte in zwei Fällen generalisierte Verlangsamungen, bei weiteren zwei Erkrankten fokale Auffälligkeiten und bei einem Patienten ließ sich ein non-konvulsiver Status epilepticus objektivieren [11].
COVID-19-Patienten, die sich mit akutem Kopfschmerz, Nackensteifigkeit, epileptischen Anfällen und Verwirrtheit vorstellen, können ebenfalls an einer Meningitis leiden [40]. Die Schädigung meningealer Blutgefäße und die Entzündung der Meningen kann zu dem klinischen Bild einer Meningitis führen [66].
Eine Enzephalopathie geht mit qualitativen und quantitativen Bewusstseinsstörungen einher. Die Patienten können sich mit Verwirrtheit, Lethargie, Delir bis hin zum Koma präsentieren. In einer französischen Datenreihe von 58 Intensivpatienten mit COVID-19 hatten 49 (84 %) neurologische Komplikationen, davon zeigten 40 (69 %) Zeichen einer Enzephalopathie [29]. Bei COVID-19-Patienten, die intensivmedizinisch behandelt wurden, mussten verschiedene andere Ursachen für eine Enzephalopathie, wie Hypoxie, Medikamente, Toxine und metabolische Entgleisungen, in Erwägung gezogen werden [55].
Anhand der begrenzten Daten kann momentan vermutet werden, dass SARS-CoV-2 eher eine immunvermittelte, als eine direkte virale Enzephalopathie auslöst. Die virusbedingte Aktivierung von Zytokinen wie Interleukin-1, Interleukin-6 oder Tumornekrosefaktor-alpha verursacht Schäden der Blut-Hirn-Schranke [66]. Mit zunehmender Schädigung der Blut-Hirn-Schranke kommt es insbesondere an den Temporallappen, wo die Blut-Hirn-Schranke schwächer ist, zu einer Invasion von Zytokinen in das Hirnparenchym [59][61]. Eine starke inflammatorische Antwort und der Eintritt von Blutbestandteilen können in epileptische Anfällen und in einer Enzephalopathie münden [66].
Komplikationen des peripheren Nervensystems und Muskelerkrankungen
Das Guillain-Barré-Syndrom (GBS) ist charakterisiert durch rasch progrediente, oft symmetrische Paresen der Extremitäten, Areflexie sowie sensible/vegetative Symptome. Bei Fallberichten von 19 Patienten (medianes Alter 63 Jahre) mit GBS und dessen Varianten begannen neurologische Symptome 7-24Tage nach dem Auftreten respiratorischer Symptome. Acht Patienten entwickelten eine respiratorische Insuffizienz, zwei hatten die Miller-Fisher-Variante des GBS mit Ophthalmoplegie, Ataxie und Areflexie [18][21][27].
GBS, auch bekannt als akute inflammatorische demyelinisierende Polyneuropathie (AIDP), kann nach einem gastrointestinalen bzw. respiratorischen Infekt auftreten. Als ursächlich werden molekulare Mimikry-Mechanismen angenommen, bei denen Epitope der Erreger ähnliche Komponenten enthalten wie Strukturen des PNS. Dies führt zu einer Stimulation von autoreaktiven B- und T-Zellen, die an Komponenten des PNS ansetzen und dieses schädigen [73]. Zytokine, die durch SARS-CoV-2 aktiviert werden, können zu einer Vaskulitis in und um Nerven und Muskeln führen [5][23] (siehe Abbildung 5). Ein Großteil der Muskelschädigung bei COVID-19 Patienten können neben Vaskulitis und Myositis einer Critical Illness Neuropathie und/oder Myopathie zugeschrieben werden [26].
In einer Beobachtungsstudie von Mao et al. lag die Rate von Patienten mit schwerer SARS-CoV-2 Infektion, die Hinweise für eine deutliche Muskelschädigung hatten bei 19 % [36]. Bis zu 70 % intensivpflichtiger Sepsispatienten entwickeln erregerunspezifisch eine Polyneuropathie oder Enzephalopathie [13]. Zur Unterscheidung, ob neurologische Manifestationen als unspezifische Ursache einer kritischen Krankheit während eines intensivmedizinischen Aufenthalts oder als spezifische Folge einer SARS-CoV-2-Infektion auftreten, bedarf es weiterer Untersuchungen. Möglicherweise handelt es sich um eine Kombination von beidem.
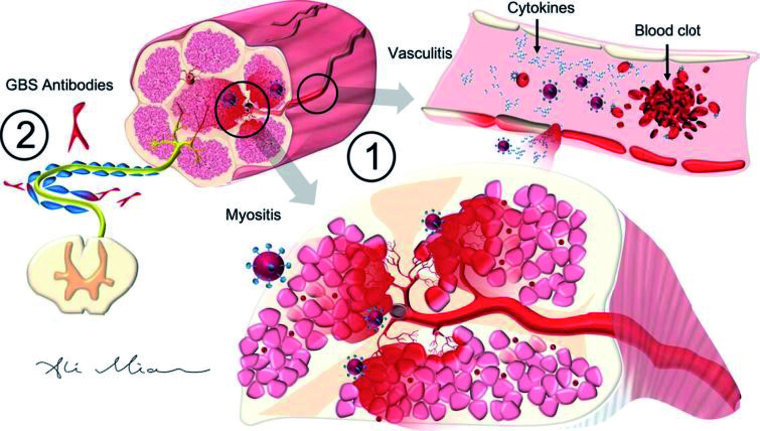
Abb. 5: Pathophysiologisches Modell der entzündlichen Beteiligung des peripheren Nervensystems mit Myositis und Vaskulitis bei SARS-CoV-2-Infektion aus FOTUHI et al. [23]:
(1) Die Aktivierung von Zytokinen durch SARS-CoV-2 führt zur inflammatorisch bedingten Schädigung epithelialer Zellen in den Gefäßen (Vaskulitis) und im Muskel (Myositis).
(2) SARS-CoV-2 kann die Bildung von Antikörpern triggern, die mit Antigenen des peripheren Nervensystems interagieren und ein Guillain-Barré-Syndrom auslösen können
Neurologische Manifestationen im Rahmen eines intensivmedizinischen Aufenthaltes kritisch Kranker
In der gegenwärtigen Situation ist der Blick des medizinischen Fachpublikums stark auf die vielfältigen neurologischen Manifestationen und Komplikationen einer COVID-19-Infektion gerichtet. Darüber hinaus dürfen die allgemein bereits bekannten neurologischen Langzeitfolgen und resultierenden Dysfunktionen des zentralen und peripheren Nervensystems bei intensivmedizinisch behandelten Patienten nicht unberücksichtigt bleiben (Abbildung 6).

Abb. 6: Wesentliche, ursachenunspezifische neurologische Manifestationen bei kritisch kranken Intensivpatienten
Komplikationen des peripheren Nervensystems und Muskelerkrankungen
Ein folgenschweres intensivmedizinisches Phänomen ist die erworbene Skelettmuskelschwäche bei kritisch Kranken (ICU aquired weakness, ICUAW). Diese primär klinisch zu diagnostizierende neu auftretende Muskelschwäche lässt sich histologisch und elektrophysiologisch in drei Untergruppen einteilen [31]:
- Critical-Illness-Polyneuropathie (CIP),
- Critical-Illness-Myopathie (CIM) und
- Mischformen beider Entitäten.
Bei 25-100 % langzeitbehandelter Intensivpatienten wurde über neuromuskuläre Störungen berichtet [16][30][35]. Für eine CIP sind pathophysiologisch Störungen der Mikrozirkulation, Entzündungsphänomene, elektrophysiologische Veränderungen und metabolische Imbalancen im Bereich des Endoneuriums und Perineuriums zu nennen, die letztlich zu einer axonalen Nervenschädigung führen. Eine CIM ist durch eine verminderte elektrophysiologische muskuläre Erregbarkeit, eine veränderte elektromechanische Kopplung und die multifaktoriell bedingte Zerstörung bzw. Apoptose der Muskelfasern charakterisiert [31]. Abzugrenzen von einer CIM ist der progrediente Muskelschwund, das „muscle wasting“, welches als ein Ungleichgewicht zwischen Synthese und Abbau muskulärer Proteine durch Immobilisation, v. a. bei septischen Patienten zu beobachten ist [14].
Klinisch werden betroffene Patienten mit CIP oder CIM meist nach der akuten Krankheitsphase auffällig, eine ausgeprägte Bewegungsarmut steht dann häufig im Kontrast zum zunehmenden Vigilanzniveau [25]. Die CIP zeigt das klassische Bild einer atrophen und distal betonten Tetraparese mit abgeschwächten Muskeldehnungsreflexen [41]. Sensible Nervenfasern sind zumeist nicht oder nur schwach durch die Polyneuropathie erfasst [57]. Das klinische Bild der CIM ähnelt einer CIP, meist sind jedoch proximale Muskelgruppen betroffen. Die Sensibilität bleibt bei CIM erhalten [72]. Ein verlängertes Weaning, die erschwerte Entwöhnung des Patienten von der Beatmung, ist das klassische Zeichen von Patienten mit erworbener Muskelschwäche und stellt das Behandlungsteam vor große Herausforderungen [14]. Diagnostisch ist die klinisch-neurologische Untersuchung häufig bei unkooperativen bzw. bewusstseinseingeschränkten Patienten nur bedingt möglich. Laborchemie und elektrophysiologische Untersuchungsmethoden haben hier einen größeren Stellenwert. Eine entsprechende Gewebebiopsie ermöglicht die definitive Diagnose [57]. Das GBS ist in die differentialdiagnostischen Überlegungen bei Verdacht auf eine CIP bei beatmeten Intensivpatienten mit aufzunehmen – fälschlicherweise wurde in der Vergangenheit eine CIP als eine Verlaufsform des GBS angesehen [72].
Zentrale respiratorische Insuffizienz
Konkurrierend zu einer durch CIP bzw. CIM verursachten Hypoventilation ist bei respiratorisch instabiler werdenden Patienten auf High-Care-Stationen stets auch eine zentrale respiratorische Dysfunktion in Betracht zu ziehen. Der unwillkürliche Atemantrieb und Atemablauf des Menschen wird durch Neuronengruppen in der Medulla oblongata gesteuert [53]. Neben primären akuten Schädigungen des Hirnstamms unterschiedlichster Genese (vaskulär, entzündlich, traumatisch, metabolisch, infektiös oder paraneoplastisch) und primär chronischen Hirnstammaffektionen (tumorös, degenerativ), rücken sekundäre Ursachen einer Hirnstammfunktionsstörung in den Fokus der Patientenversorgung kritisch kranker Patienten ohne primäre Hirnschädigung [47][51]. Das SARS-CoV-2 steht aufgrund eines möglichen Neurotropismus ebenfalls im Verdacht, die kardiorespiratorischen Zentren in der Medulla oblongata schädigen zu können [35]. Unabhängig vom Schädigungsmechanismus kann es je nach Läsionsort im zentralen Nervensystem zu einer Schädigung des zentralen Atemzentrums kommen. Je kaudaler der Schädigungsort im Hirnstamm lokalisiert ist, desto eher ist der zentrale Atemantrieb vermindert [10]. Neben der schweren Grunderkrankung selbst, sind es oft die Begleitumstände eines Aufenthaltes auf der Intensivstation unter langanhaltender Medikation mit Sedativa und Analgetika, die zur Erlöschung der Hirnstammreflexe führen [47][51][52]. Elektrophysiologische Untersuchungen der Atemmuskulatur können zur differenzialdiagnostischen Einordnung zwischen peripherer oder zentraler Ursache einer respiratorischen Dysfunktion hilfreich sein [50].
Intensivpflichtige Patienten zeigen häufig vegetative Störungen mit verminderter Herzfrequenz- und Blutdruckvariabilität, bei gleichzeitig verringertem Sympathikotonus und Baroreflex [6][46].Eine eingeschränkte Variabilität des Atemzugsvolumens korreliert mit einem erschwerten Weaning bei mechanisch beatmeten Intensivpatienten [67].Neurophysiologische Untersuchungen mittels „Brainstem auditory evoked potentials“ (BAEP) oder EEG unterstützen die Hypothese einer Hirnstammfunktionsstörung, beispielsweise bei septischen Patienten [2][8][9].
Ein für die genannten neurologischen Komplikationen in der intensivmedizinischen Behandlung postulierter neuroinflammatorischer Schädigungsmechanismus, kann über zwei unterschiedliche Wege autonome Zentren im Hirnstamm schädigen: Der humorale Weg über die Diffusion von zirkulierenden Entzündungsmediatoren in die Area postrema und der neuronale Weg über den Nervus vagus, welcher inflammatorische Signale aus der Körperperipherie weiterleitet, können über neuronale Apoptose die vegetativen Funktionen stören [12][37][49].
Delir
Häufig werden Patienten in intensivmedizinischer Behandlung durch eine delirante Symptomatik auffällig. Das Delir wird charakterisiert durch eine akut auftretende fluktuierende Bewusstseinsstörung, eine verminderte Aufmerksamkeit und verminderte kognitive Fähigkeiten sowie eine motorische Hypo- oder Hyperaktivität [22][24]. Gemeinhin akzeptiert wird auch hier eine neuroinflammatorische Hypothese. Wie bereits für die Hirnstammfunktionsstörung beschrieben, werden bei schwer erkrankten Patienten systemische Zytokine und proinflammtorische Mediatoren hämatogen ausgeschwemmt und erreichen das zentrale Nervensystem über Nervus vagus, Plexus choroideus und die zirkumventrikulären Organe [19]. Über endotheliale Aktivierung, erhöhte mikrovaskuläre Permeabilität und ein prokoagulatorisches Milieu kommt es zu einem Zusammenbrechen der Blut-Hirn-Schranke und zu mikrozirkulatorischen Störungen [1][3][4]. Betroffene Patienten können einen symptomatischen epileptischen Anfall erleiden [61]. Schäden des aufsteigenden retikulären Aktivierungssystems (ARAS), begünstigen im Falle einer Hirnstammdysfunktion über eine Störung des Schlaf-Wach-Zyklus das Auftreten eines Delirs [10]. Das intensivmedizinische Behandlungssetting mit Maßnahmen wie Beatmung, Monitoring, Sedierung und Immobilisierung fördert das Auftreten eines Delirs [63], welches auch kognitive Langzeitschäden ehemaliger Intensivpatienten begünstigt [24].
Fazit
COVID-19 kann mit einer entzündlichen Beteiligung von Gefäßen, Muskeln und Nerven des ZNS und PNS einhergehen. Dies scheint spezifisch durch direkte virale Infektion, para-infektiöse/immunologische Komplikationen oder unspezifisch durch die intensivpflichtige, schwere Erkrankung als solche bedingt zu sein.
Neurologische Komplikationen, insbesondere Enzephalitis und Schlaganfälle, im Rahmen einer SARS-CoV-2-Infektion bzw. eines intensivmedizinischen Aufenthalts können eine lebenslange körperliche Behinderung und neuropsychiatrische Langzeitfolgen nach sich ziehen.
Bedeutsam erscheint die frühzeitige fachspezifische Mitbeurteilung und Mitbehandlung, um neurologische Komplikationen erkennen und geeignete therapeutische Maßnahmen ergreifen zu können. Für die Verbesserung der Langzeitprognose sollte sich bei Patienten mit überdauernden neurologischen Komplikationen nach der Akutphase eine neurologische Rehabilitation anschließen.
Es bedarf weiterer Beobachtungen und Untersuchungen, um das längerfristige Ausmaß neurologischer Manifestationen im Rahmen COVID-19-Pandemie abschätzen zu können.
Kernaussagen
- Es gibt zunehmende Hinweise einer neurologischen Mitbeteiligung im Rahmen einer SARS-CoV-2-Infektion von Frühsymptomen bis zu neuropsychiatrischen Langzeitfolgen oder infaustem Verlauf.
- Zentrales und peripheres Nervensystem sind betroffen. Spezifische Folgen einer SARS-CoV-2-Infektion sowie unspezifische Folgen einer intensivpflichtigen, kritischen Erkrankung sind bedeutsam.
- Überdauernde Behinderungen aufgrund neurologischer Komplikationen einer SARS-CoV-2-Infektion können auftreten.
- Bei COVID-19 sind neurologische Symptome zu bedenken; bei neurologischen Symptomen muss eine SARS-CoV-2-Infektion in Erwägung gezogen werden.
Literatur
- Abbott NJ, Ronnback L, Hansson E: Astrocyte-endothelial interactions at the blood-brain barrier. Nature reviews Neuroscience 2006; 7(1): 41–53. mehr lesen
- Admiraal MM, Gilmore EJ, Van Putten MJAM, et al.: Disruption of brain-heart coupling in sepsis. J Clin Neurophysiol Off Publ Am Electroencephalogr Soc 2017; 34(5): 413–420. mehr lesen
- Aird WC: The role of the endothelium in severe sepsis and multiple organ dysfunction syndrome. Blood 2003; 101(10): 3765–3777. mehr lesen
- Ait-Oufella H, Maury E, Lehoux S, Guidet B, Offenstadt G:The endothelium: physiological functions and role in microcirculatory failure during severe sepsis. Intensive care medicine 2010; 36(8): 1286–1298. mehr lesen
- Ang CW, Jacobs BC, Laman JD (2004) The Guillain Barre syndrome: a true case of molecular mimicry. ́ Trends Immunol 2004; 25: 61-66. mehr lesen
- Annane D, Trabold F, Sharshar T, et al.: Inappropriate sympathetic activation at onset of septic shock: a spectral analysis approach. Am J Respir Crit Care Med 1999; 160(2): 458–465. mehr lesen
- Avula A, Nalleballe K, Narula N, Sapozhnikov S, Dandu V, Toom S, Glaser A, Elsayegh D (2020) COVID19 presenting as stroke. Brain Behav Immun 2020: 87: 115-119. mehr lesen
- Azabou E, Magalhaes E, Braconnier A, et al.: Early standard electroencephalogram abnormalities predict mortality in septic intensive care unit patients. PLoS One 2015; 10(10): e0139968. mehr lesen
- Azabou E, Rohaut B, Heming N, et al.: Early impairment of intracranial conduction time predicts mortality in deeply sedated critically ill patients: a prospective observational pilot study. Ann Intensive Care 2017; 7(1): 63. mehr lesen
- Benghanem S, Mazeraud A, Azabou E, et al.: Brainstem dysfunction in critically ill patients. Crit Care 2020; 24(5): 2718-2719. mehr lesen
- Bernard-Valnet R, Pizzarotti B, Anichini A et al.: Two patients with acute meningoencephalitis concomitant with SARS-CoV-2 infection [published online ahead of print, 2020 May 7]. Eur J Neurol. 2020; 10.1111/ene.14298. mehr lesen
- Blomqvist A, Engblom D: Neural mechanisms of inflammation-induced fever. Neuroscientist 2018; 24(4): 381–399. mehr lesen
- Bolton CF, Young GB, Zochodne DW. The neurological complications of sepsis. Ann Neurol 1993; 33: 94–100. mehr lesen
- Callahan LA, Supinski GS: Sepsis-induced myopathy. Crit Care Med 2009; 37: 354–367. mehr lesen
- Cummins D, Bennett D, Fisher-Hoch SP, Farrar B, Machin SJ, McCormick JB. Lassa fever encephalopathy: clinical and laboratory findings. J Trop Med Hyg. 1992; 95(3): 197-201. mehr lesen
- De Jonghe B, Sharshar T, Lefaucheur JP, et al.: Paresis acquired in the intensive care unit: a prospective multicenter study. JAMA 2002; 288: 2859–2867. mehr lesen
- Desforges M, Le Coupanec A, Dubeau P, et al. Human coronaviruses and other respiratory viruses: underestimated opportunistic pathogens of the central nervous system? Viruses 2019; 12: 12. mehr lesen
- Dinkin M, Gao V, Kahan J, et al.: COVID-19 presenting with ophthalmoparesis from cranial nerve palsy. Neurology 2020; 95(5): 221-223 mehr lesen
- Downing JE, Miyan JA: Neural immunoregulation: emerging roles for nerves in immune homeostasis and disease. Immunology today 2000; 21(6): 281–289. mehr lesen
- Duong L, Xu P, Liu A: Meningoencephalitis without respiratory failure in a young female patient with COVID-19 infection in downtown Los Angeles, early April 2020. Brain Behav Immun 2020; 87: 33.published online April 17. https://doi.org.10.1016/j.bbi.2020.04.024. mehr lesen
- Ellul MA, Benjamin L, Singh B et al. Neurological associations of COVID-19. The Lancet Neurology 2020. Published online July 2. mehr lesen
- Ely EW, Inouye SK, Bernard GR, et al.: Delirium in mechanically ventilated patients: validity and reliability of the confusion assessment method for the intensive care unit (CAM-ICU). JAMA 2001; 286(21): 2703–2710. mehr lesen
- Fotuhi M, Mian, A, Meysami S et al. Neurobiology of COVID-19. Journal of Alzheimer's Disease 2020; 76 (1): 3-19. mehr lesen
- Girard TD, Jackson JC, Pandharipande PP, et al.: Delirium as a predictor of long- term cognitive impairment in survivors of critical illness. Crit Care Med 2010; 38(7): 1513–1520. mehr lesen
- Griffiths RD, Hall J: Intensive care unit- acquired weakness. Crit Care Med 2010; 38: 779–787. mehr lesen
- Guidon AC, Amato AA: COVID-19 and neuromuscular disorders. Neurology 2020; 94: 959-969. mehr lesen
- Gutierrez-Ortiz C, Mendez A, Rodrigo-Rey S et al.: Miller Fisher Syndrome and polyneuritis cranialis in COVID-19. Neurology 2020; 95(5): e601-e605. https://doi.org.10.1212/WNL.0000000000009619. mehr lesen
- Hamming I, Timens W, Bulthuis ML, Lely AT, Navis G, van Goor H: Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol 2004; 203: 631–637. mehr lesen
- Helms J, Kremer S, Merdji H et al.: Neurologic features in severe SARS-CoV-2 infection. N Engl J Med 2020; 382: 2268–2270. mehr lesen
- Hund E: Neurological complications of sepsis: critical illness polyneuropathy and myopathy. J Neurol 2001; 248: 929–934. mehr lesen
- Judemann K, Lunz D, Zausig YA, Graf BM, Zink W: Intensive care unit-acquired weakness in the critically ill: critical illness polyneuropathy and critical illness myopathy. Anaesthesist 2011; 60: 887–901. mehr lesen
- Lechien JR, Chiesa-Estomba CM, De Siati DR et al.: Olfactory and gustatory dysfunctions as a clinical presentation of mild-to-moderate forms of the coronavirus disease (COVID-19): a multicenter European study. Eur Arch Otorhinolaryngol. 2020; 277(8): 2251-2261. . mehr lesen
- Leijten FS, De Weerd AW, Poortvliet DC et al.: Critical illness polyneuropathy in multiple organ dysfunction syndrome and weaning from the ventilator. Intensive Care Med 1996; 22: 856–861. mehr lesen
- Li Y, Li M, Wang M et al.: Acute Cerebrovascular Disease Following COVID19: A Single Center, Retrospective, Observational Study. Stroke Vasc Neurol 2020; svn-2020-000431. mehr lesen
- Li YC, Bai WZ, Hashikawa T: The neuroinvasive potential of SARS‐CoV2 may play a role in the respiratory failure of COVID‐19 patients. J Med Virol 2020; 10.1002/jmv.25728. mehr lesen
- Mao L, Jin H, Wang M et al.: Neurologic manifestations of hospitalized patients with coronavirus disease 2019 in Wuhan, China. JAMA Neurol 2020; 77(6): 1-9. mehr lesen
- Mazeraud A, Pascal Q, Verdonk F et al.: Neuroanatomy and physiology of brain dysfunction in sepsis. Clin Chest Med 2016; 37(2): 333–345. mehr lesen
- Mehta P, Mcauley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ: COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet 2020; 395: 1033- 1034. mehr lesen
- Merkler AE, Parikh NS, Mir S et al.: Risk of Ischemic Stroke in Patients With Coronavirus Disease 2019 (COVID-19) vs Patients With Influenza [published online ahead of print, 2020 Jul 2]. JAMA Neurol. 2020; e202730. mehr lesen
- Moriguchi T, Harii N, Goto J et al.: A first case of meningitis/encephalitis associated with SARS-coronavirus-2. Int J Infect Dis 2020; 94: 55–58. mehr lesen
- Muellges W, Stoll G: Critical-illness-Poly- neuropathie und -Myopathie. Dtsch Med Wochenschr 2011; 136: 769–774. mehr lesen
- Oxley TJ, Mocco J, Majidi S et al.: Clinical Characteristics of Five Young Patients Presenting with Large-Vessel Stroke. NEJM 2020; 382(20): e60. mehr lesen
- Pagliano P, Spera AM, Ascione T, Esposito S: Infections causing stroke or stroke-like syndromes. Infection 2020; 48: 323-332. mehr lesen
- Paterson RW, Brown RL, Benjamin L et al.: The emerging spectrum of COVID-19 neurology: clinical, radiological and laboratory findings [published online ahead of print, 2020 Jul 8]. Brain. 2020; awaa240. mehr lesen
- Pilotto A, Odolini S, Stefano Masciocchi S et al.: Steroid-responsive encephalitis in Coronoavirus disease 2019. Ann Neurol 2020; published online May 17. https://doi.org.10.1002/ana.25783. mehr lesen
- Pomeranz B, Macaulay RJ, Caudill MA et al.: Assessment of autonomic function in humans by heart rate spectral analysis. Am J Physiol 1985; 248(1 Pt 2): H151–153. mehr lesen
- Rohaut B, Porcher R, Hissem T et al.: Brainstem response patterns in deeply-sedated critically-ill patients predict 28-day mortality. PLoS One 2017; 12(4): e0176012. mehr lesen
- Román GC, Spencer PS, Reis J et al.: The neurology of COVID-19 revisited: A proposal from the Environmental Neurology Specialty Group of the World Federation of Neurology to implement international neurological registries. J Neurol Sci. 2020; 414: 116884. doi:10.1016/j.jns.2020.116884. mehr lesen
- Roth J, Harré EM, Rummel C, Gerstberger R, Hübschle T: Signaling the brain in systemic inflammation: role of sensory circumventricular organs. Front Biosci J Virtual Libr 2004; 9: 290–300. mehr lesen
- Schmidt M, Kindler F, Gottfried SB et al.: Dyspnea and surface inspiratory electromyograms in mechanically ventilated patients. Intensive Care Med 2013; 39(8): 1368–1376. mehr lesen
- Sharshar T, Porcher R, Siami S et al.: Brainstem responses can predict death and delirium in sedated patients in intensive care unit. Crit Care Med 2011; 39(8): 1960–1967. mehr lesen
- Shehabi Y, Howe BD, Bellomo R et al.: Early sedation with dexmedetomidine in critically ill patients. N Engl J Med 2019; 380(26): 2506–2517. mehr lesen
- Smith JC, Ellenberger HH, Ballanyi K, Richter DW, Feldman JL: Pre-Bötzinger complex: a brainstem region that may generate respiratory rhythm in mammals. Science 1991; 254(5032): 726–729. mehr lesen
- Sohal S, Mossammat M: COVID-19 presenting with seizures. Science Direct IDCases 2020; 20: e00782. mehr lesen
- Solomon T, Michael BD, Smith PE et al. Management of suspected viral encephalitis in adults—Association of British Neurologists and British Infection Association National Guidelines. J Infect 2012; 64: 347–73. mehr lesen
- Spiezia L, Boscolo A, Poletto F, Cerruti L, Tiberio I, Campello E, Navalesi P, Simioni P: COVID-19- related severe hypercoagulability in patients admitted to intensive care unit for acute respiratory failure. Thromb Haemost 2020; 120: 998-1000. mehr lesen
- Stevens RD, Marshall SA, Cornblath DR et al.: A framework for diagnosing and classifying intensive care unit-acquired weakness. Crit Care Med 2009; 37: 299–308. mehr lesen
- Sungnak W, Huang N, Becavin C et al.: (2020) SARS-cov-2 entry factors are highly expressed in nasal epithelial cells together with innate immune genes. Nat Med 2020; 26: 681-687. mehr lesen
- Sweeney MD, Sagare AP, Zlokovic BV: Blood–brain barrier breakdown in Alzheimer’s disease and other neurodegenerative disorders. Nat Rev Neurol 2018; 14, 133-150. mehr lesen
- Vaira LA, Salzano G, Fois AG, Piombino P, Riu GD: Potential pathogenesis of ageusia and anosmia in COVID-19 patients. Int Forum Allergy Rhinol 2020; 10.1002/alr.22593., doi.org/10.1002/alr.22593. mehr lesen
- van Vliet EA, da Costa Araujo S, Redeker S, van Schaik R, Aronica E, Gorter JA: Blood-brain barrier leakage may lead to progression of temporal lobe epilepsy. Brain 2007; 130: 521-534. mehr lesen
- Varga Z, Flammer AJ, Steiger P et al.: Endothelial cell infection and endotheliitis in COVID-19. Lancet 2020; 395: 1417–1418. mehr lesen
- Vasilevskis E, Pandharipande P, Graves A et al.: Validation of a modified Sequential Organ Failure Assessment (SOFA) score incorporating the Richmond Agitation-Sedation Score (RASS) to assess neurologic end-organ function. Am J Respir Crit Care Med 2013; 187: A1551. mehr lesen
- Vollono C, Rollo E, Romozzi M et al.: Focal status epilepticus as unique clinical feature of COVID-19: a case report. Seizure 2020; 78: 109–12. mehr lesen
- Wong PF, Craik S, Newman P et al.: Lessons of the month 1: a case of rhombencephalitis as a rare complication of acute COVID-19 infection. Clin Med (Lond) 2020; 20(3): 293-294. mehr lesen
- Wu Y, Xu X, Chen Z, Duan J, Hashimoto K, Yang L, Liu C, Yang C: Nervous system involvement after infection with COVID-19 and other coronaviruses. Brain Behav Immun 2020; 87: 18-22. mehr lesen
- Wysocki M, Cracco C, Teixeira A et al.: Reduced breathing variability as a predictor of unsuccessful patient separation from mechanical ventilation. Crit Care Med 2006; 34(8): 2076–2083. mehr lesen
- Xiong M, Liang X, Wei Y: Changes in blood coagulation in patients with severe coronavirus disease 2019 (COVID-19): a meta-analysis. Br J Haematol 2020; 189(6): 1050-1052. mehr lesen
- Xu H, Zhong L, Deng J, Peng J, Dan H, Zeng X, Li T, Chen Q: High expression of ACE2 receptor of 2019- ncov on the epithelial cells of oral mucosa. Int J Oral Sci 2020; 12: 8. mehr lesen
- Yaghi S, Ishida K, Torres J et al.: SARS-CoV-2 and Stroke in a New York Healthcare System [published correction appears in Stroke. 2020 Aug;51(8):e179]. Stroke. 2020; 51(7): 2002-2011. mehr lesen
- Yan R, Zhang Y, Li Y, Xia L, Guo Y, Zhou Q: Structural basis for the recognition of SARS-CoV-2 by full-length human ACE2. Science 2020; 367: 1444–48. mehr lesen
- Zochodne DW, Bolton CF, Wells GA et al.: Critical illness polyneuropathy. A complication of sepsis and multiple organ failure. Brain 1987; 110 (Pt 4): 819–841. mehr lesen
- Zubair AS, McAlpine LS, Gardin T et al. Neuropathogenesis and Neurologic Manifestations of the Coronaviruses in the Age of Coronavirus Disease 2019. JAMA Neurol 2020, May 29 doi:0.1001/jamaneurol.2020.2065. mehr lesen
Erklärung zum Interessenkonflikt
Die Verfasser erklären, dass kein Interessenkonflikt im Sinne der Richtlinien des International Committee of Medical Journal Editors besteht.
Manuskriptdaten
Eingereicht: 30. Juli 2020
Angenommen: 12. August 2020
Zitierweise
Sigl A, Heinz P, Meister M, Harth A, Metrikat J: Neurologische Manifestationen bei SARS-CoV-2-Infektion und intensivpflichtigen COVID-19 Patienten. WMM 2020; 64(9): e29.
Für die Verfasser
Oberstarzt Dr. Jens Metrikat
Bundeswehrkrankenhaus Ulm, Klinik für Neurologie
Oberer Eselsberg 40, 89081 Ulm
E-Mail: jensmetrikat@bundeswehr.org
Manuscript data
Submitted: 30 July 2020
Accepted: 12 August 2020
Citation
Sigl A, Heinz P, Meister M, Harth A, Metrikat J: Neurological manifestations in SARS-CoV-2 infection and intensive care patients with COVID-19; WMM 2020; 64(9): e29.
For the authors
Colonel (MC) Dr. Jens Metrikat
Bundeswehr Hospital Ulm, Department for Neurology
Oberer Eselsberg 40, D-89081 Ulm
E-Mail: jensmetrikat@bundeswehr.org