
SICHERE ARZNEIMITTEL
SARS-CoV-2-Pandemie: Maßnahmen des
Arzneimittelüberwachungsbeauftragten der Bundeswehr
Matthias Meyer a
a Überwachungsstelle für öffentlich-rechtliche Aufgaben des Sanitätsdienstes der Bundeswehr Süd – Arzneimittelüberwachungsbeauftragter der Bundeswehr, München
Hintergrund
Seit Beginn der SARS-CoV-2-Pandemie unterstützt der Arzneimittelüberwachungsbeauftragte der Bundeswehr (AMÜbwBeauftrBw, kurz AMÜBBw) das Gesundheitssystem der Bundeswehr mit regulatorischen Maßnahmen auf Grundlage des Arzneimittel- bzw. Medizinproduktegesetzes mit dem Ziel
- systemrelevantes Personal zu schützen,
- Arzneimittel- und Medizinprodukteengpässe zu überbrücken und
- den behandelnden Ärztinnen und Ärzten Therapieoptionen bei der Versorgung von an COVID-19 erkrankten Patientinnen und Patienten zu eröffnen.
Als die zuständige Behörde der Bundeswehr im Sinne des Arzneimittel- bzw. Medizinproduktegesetzes steht AMÜBBw in einem kontinuierlichen Austausch mit
- den Bundeswehrapotheken,
- den Unterabteilungen V und X des Kommandos Sanitätsdienst der Bundeswehr (KdoSanDstBw),
- den Referaten Führung Streitkräfte Sanität 2 und 3 des Bundesministeriums der Verteidigung (BMVg),
- den zuständigen Bundesoberbehörden sowie
- den zivilen pharmazeutischen Kollegialbehörden der Bundesländer.
Das dynamische epidemische Geschehen in Deutschland seit Beginn dieses Jahres hat eine kontinuierliche Bewertung der Arzneimittelversorgung auch im Geschäftsbereich des BMVg notwendig gemacht. Es galt und gilt, mögliche Auswirkungen der SARS-CoV-2-Pandemie auf die Arzneimittelversorgung in der Bundeswehr frühzeitig zu erkennen, um rechtzeitig Maßnahmen auf den verschiedenen Handlungsebenen ergreifen zu können.
Arzneimittelrecht im Krisenfall
Unabhängig von der Feststellung der „epidemischen Lage von nationaler Tragweite“ durch den Deutschen Bundestag Ende März und der danach in Kraft getretenen Gesetze zum Schutz der Bevölkerung sind im Arzneimittelgesetz (AMG) in Krisenzeiten verschiedene Ausnahmen von den Bestimmungen des Gesetzes vorgesehen. Dies kann beispielsweise erforderlich werden, wenn die notwendige Versorgung der Bevölkerung mit Arzneimitteln ernstlich gefährdet ist oder eine bedrohliche übertragbare Krankheit auftritt, deren Ausbreitung eine sofortige und das übliche Maß erheblich überschreitende Bereitstellung von spezifischen Arzneimitteln erforderlich macht. Mit Ausnahmeregelungen haben die zuständigen Behörden der Bundesländer und der Bundeswehr schon früh von der Möglichkeit Gebrauch gemacht, lageangepasste regulatorische Maßnahmen zu ergreifen, um der Ausbreitung der Pandemie in Deutschland zu begegnen.
Versorgungsmangel festgestellt
Ende Februar 2020 stellte das Bundesministerium für Gesundheit (BMG) fest, dass weltweit keine zugelassenen Arzneimittel zur Behandlung einer Infektion mit dem neuartigen Coronavirus zur Verfügung stehen. Gleichzeitig handelt es sich bei COVID-19 jedoch um eine bedrohliche übertragbare Krankheit, deren Ausbreitung eine sofortige und das übliche Maß erheblich überschreitende Bereitstellung spezifischer Arzneimittel erforderlich macht.
Die Feststellung und Bekanntmachung eines Versorgungsmangels durch das BMG ist die Voraussetzung dafür, dass die zuständigen Behörden der Länder bzw. der Bundeswehr im Einzelfall gestatten können, dass in Deutschland nicht zugelassene Arzneimittel ggf. in größerem Umfang eingeführt und befristet in den Verkehr gebracht werden können. Darüber hinaus können die zuständigen Behörden auch ein befristetes Abweichen von Erlaubnis- oder Genehmigungserfordernissen oder von anderen Ver- und Geboten des AMG gestatten.
Beispiel: Chirurgische Desinfektionsmittel
Schon in der Frühphase der Pandemie hatte die Verbreitung von SARS-CoV-2 in Deutschland eine stark erhöhte Nachfrage an Händedesinfektionsmitteln ausgelöst, was nicht unerhebliche Lieferengpässe zur Folge hatte. Um diese Engpässe zu überbrücken und die Versorgung von Patienten sowie von medizinischem Personal sicherzustellen, konnte AMÜBBw den Bundeswehrapotheken Anfang März auf Grundlage der oben genannten Bekanntmachung gestatten, Desinfektionsmittel zur medizinischen Haut- und Händedesinfektion über die durch das AMG vorgeschriebene Mengenbeschränkung hinaus herzustellen und im Bereich der Bundeswehr ohne Zulassung in den Verkehr zu bringen.
Einfuhr von Arzneimitteln
Im weiteren Verlauf der Pandemie konzentrierte sich die Anwendung von Arzneimitteln zur Behandlung von COVID-19 in Deutschland unter anderem auf Wirkstoffe, deren Sicherheitsprofile als zugelassene Arzneimittel aus anderen Indikationsgebieten bereits bekannt waren und die als potenzielle Therapieoptionen gegen COVID-19 angesehen wurden. Da es sich bei einer COVID-19-Therapie mit diesen Wirkstoffen immer um einen individuellen Heilversuch ohne klinische Wirksamkeitsnachweise handelt, wurde sie vorrangig bei Patientinnen und Patienten mit schweren Verlaufsformen und patientenindividuell unter sorgfältiger Abwägung des Nutzen-Risiko-Verhältnisses eingesetzt.
Da keines dieser Arzneimittel über eine Zulassung in Deutschland verfügt, leitete das BMG eine zentrale Beschaffung von Arzneimitteln mit den Wirkstoffen Chloroquin und Hydroxychloroquin sowie von antiviral wirksamen Therapeutika mit den Wirkstoffen Lopinavir und Ritonavir, Favipiravir sowie Camostat ein, die über das Bundesamt für Ausrüstung, Informationstechnik und Nutzung der Bundeswehr (BAAINBw) abgewickelt wurde. AMÜBBw wurde frühzeitig durch BMVg und BAAINBw in den Beschaffungsvorgang eingebunden, so dass die für die Einfuhr erforderlichen Gestattungen und Bescheinigungen des öffentlichen Interesses unmittelbar erstellt werden konnten. Auch die Bundeswehrapotheken konnten von dieser Einfuhrerleichterung Gebrauch machen, um weitere potenziell gegen COVID-19 wirksame Arzneimittel zu beschaffen – z. B. Remdesivir zur Therapie der in den Bundeswehrkrankenhäusern behandelten schwerstkranken italienischen Patienten.
Sauerstofferzeugungsanlagen
Um die Versorgung mit medizinischem Sauerstoff zuverlässig und schnell auch bei Lieferengpässen ziviler Lieferanten sicherzustellen, wurden durch den Sanitätsdienst der Bundeswehr vier mobile Sauerstofferzeugungs- und Abfüllanlagen aufgebaut, die von den Bundeswehrapotheken Blankenburg, Koblenz, Quakenbrück und Ulm (am Standort Dornstadt) betrieben werden. Allen vier Anlagen wurde die apothekenrechtliche Betriebserlaubnis durch AMÜBBw im Rahmen von Abnahmeinspektionen erteilt, so dass durch die Bundeswehrapotheken seit Anfang April bis zu 400 000 Liter medizinischer Sauerstoff 93 % pro Anlage und Tag produziert werden können.
Die Abbildung gibt einen Überblick über die ergriffenen regulatorischen Maßnahmen im Zeitraum März und April 2020.
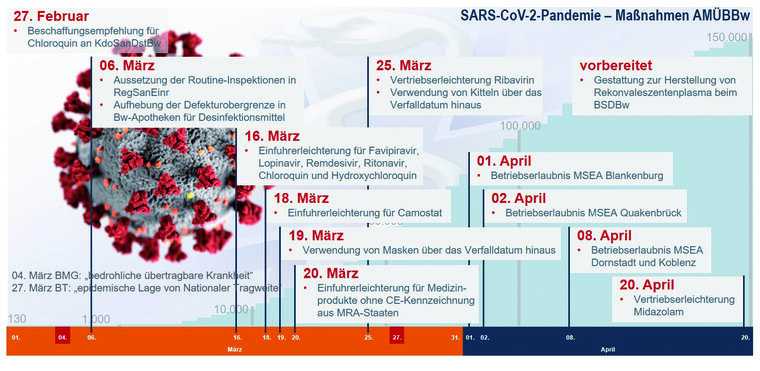
Abb. 1: Maßnahmen AMÜBBw im Rahmen der SARS-CoV-2-Pandemie zwischen dem 27. Februar und 20. April 2020
Fazit
Die Arzneimittel- und Medizinproduktesicherheit in der Bundeswehr ist auch in Krisensituationen zu jeder Zeit gewährleistet – dieses Fazit kann uneingeschränkt als Erfahrung nach den ersten Monaten der COVID-19-Pandemie gezogen werden. Zugleich wird durch die bundeswehreigene Behörde AMÜBBw gewährleistet, dass der Sanitätsdienst im Sinne einer Patientenversorgung auf hohem medizinischem Niveau im Eigenvollzug auch auf regulatorischer Ebene flexibel auf Lageänderungen reagieren kann.
Verfasser
Oberstapotheker Matthias Meyer
Überwachungsstelle für öffentlich-rechtliche Aufgaben des Sanitätsdienstes der Bundeswehr Süd – Arzneimittelüberwachungsbeauftragter der Bundeswehr
Dachauer Str. 128, 80637 München
E-Mail: matthiasmeyer@bundewehr.org