ARTIKELSERIE „ECMO IN DER WEHRMEDIZIN“
Wehrmedizinische Relevanz der Extrakorporalen Membranoxygenierung (ECMO) –
Teil I: Zur Rolle der ECMO auf den Intensivstationen des Bundeswehrzentralkrankenhauses Koblenz
Relevance of ECMO in military medicine –
Part I: The role of ECMO in intensive care at the Bundeswehr Central Hospital Koblenz
Florian Meyer-Oschatza, Matthias Endlich b, Richard Feyrer b, Daniel Bredenkötter c, Willi Schmidbauer c, Christoph Jänig c
a Kommando Sanitätsdienst der Bundeswehr, Koblenz
b Bundeswehrzentralkrankenhaus Koblenz, Klinik XVII – Herzchirurgie
c Bundeswehrzentralkrankenhaus Koblenz, Klinik X – Anästhesie, Intensivmedizin und Notfallmedizin
Zusammenfassung
Die konservative Behandlung intensivpflichtiger Patienten im akuten Herz- und/oder Lungenversagen ist schwierig und in ihren Erfolgsaussichten limitiert. Die Entwicklung der Extrakorporalen Membranoxygenierung (ECMO) in den letzten Jahren hat hier neue Möglichkeiten zur Behandlung auch solcher Patienten eröffnet, die ohne diese Methode keine Überlebenschance haben. Dieses gilt z. B. für ein akutes Lungenversagen bei Sepsis und schwerem Thoraxtrauma und ist somit auch im Rahmen der Behandlung einsatzbedingter Verletzungen von Bedeutung. In drei Beiträgen soll deshalb die wehrmedizinische Relevanz dieser Behandlungsmethode erörtert werden.
Diese erste hierzu vorliegende Arbeit umfasst die Kernaspekte zum Thema der ECMO. Sie gibt einen Überblick über die wissenschaftlichen Grundlagen, beschreibt das generelle Funktionsprinzip, die Indikationsstellung, Kontraindikationen sowie Komplikationen und diskutiert Aspekte des Crew-Ressource-Managements.
Abschließend erfolgt nach einer Diskussion der wehrmedizinischen Relevanz des Verfahrens eine Übersicht der Datenlage der ECMO-Einheit des Bundeswehrzentralkrankenhauses (BwZKrhs) Koblenz als kardiochirurgisches Zentrum mit ECMO-Fähigkeit im Systemverbund der Bundeswehrkrankenhäuser.
Schlüsselwörter: ARDS, Lungenversagen, ECMO, blast-injury, Herzchirurgie, AirMedEvac, ECMO
Summary
Conservative treatment of intensive care patients with acute respiratory distress syndrome (ARDS) is highly difficult and often of limited success. The development of the technology “Extracorporal Membrane Oxygenation” (ECMO) over the last years presented new options to treat patients who before had no chance to survive. As combat related injuries like sepsis or severe thorax trauma can lead to ARDS ECMO is of relevance in military medicine. This item will be presented and discussed by 3 articles in this journal.
This first article comprehensively describes the core aspects of extracorporeal membrane oxygenation (ECMO). It gives an overview over the scientific basis of ECMO, describes the general function, medical indication, contraindication and complications and discusses crew-resource-management aspects.
Finally, the relevance of ECMO in the context of military medicine is discussed an the experiences of the Bundeswehr Central Hospital Koblenz as a cardiosurgical center with ECMO capability in the system network of the Bundeswehr hospitals are presented.
Keywords : ARDS, respiratory failure, ECMO, blast-injury, cardiac surgery, aeromedical evacuation
Einleitung
Die konservative Therapie intensivpflichtiger Patienten im akuten Herz- und/oder Lungenversagen ist äußerst schwierig und in ihren Möglichkeiten begrenzt [3]. Hier hielt bereits frühzeitig 1 eine miniaturisierte Version einer Herz-Lungen-Maschine, die sogenannte Extrakorporale Membranoxygenierung (Extracorporal Membrane Oxygenation, ECMO), Einzug in die Therapie. Zu Beginn war das Verfahren mit einer Vielzahl von Komplikationen, wie Blutungen, Hämolyse, Embolien und Thrombosen, behaftet. Erst mit Entwicklung moderner Membranoxygenatoren konnte die Komplikationsrate deutlich gesenkt werden [29].
Die ersten Studien erbrachten den Nachweis eines Überlebensvorteils bei Neugeborenen und Kleinkindern, nicht aber bei Erwachsenen [2]. Die im Laufe der letzten Dekaden immer wiederkehrenden viralen Epidemien und Grippewellen führten zu einem stetigen Anstieg der Häufigkeit der ECMO-Therapie. Ziel zahlreicher Forscher ist es, den Nutzen der ECMO-Therapie gegenüber der konservativen Behandlung des ARDS zu belegen [18][21].
In unserer Arbeit fokussieren wir auf Erwachsene mit einem akuten Lungenversagen (Acute Respiratory Distress Syndrome, ARDS), dessen auslösende Faktoren mannigfaltig sind. So können z. B. eine schwere Infektion der Lunge, eine Sepsis oder ein starkes Thoraxtrauma in ein ARDS münden.
Die Inzidenz des ARDS liegt in Europa bei 7/100 000 Einwohnern [20][28]. Definiert wird es nach der Berlin-Definition [26], sein Schweregrad wird nach dem Horovitz-Quotienten (Verhältnis von PaO2 zu FiO2) eingeteilt (Tabelle 1).

Tab.1: Berlin-Definition des ARDS (nach [26])
Ein ARDS weist eine hohe Letalität zwischen 43 % und 48 % auf [23][28][29]. In diesen Fällen kann gemäß aktueller Therapieempfehlungen ein Einsatz der extra-korporalen Membranoxygenierung (ECMO) erfolgen (Abbildung 1).
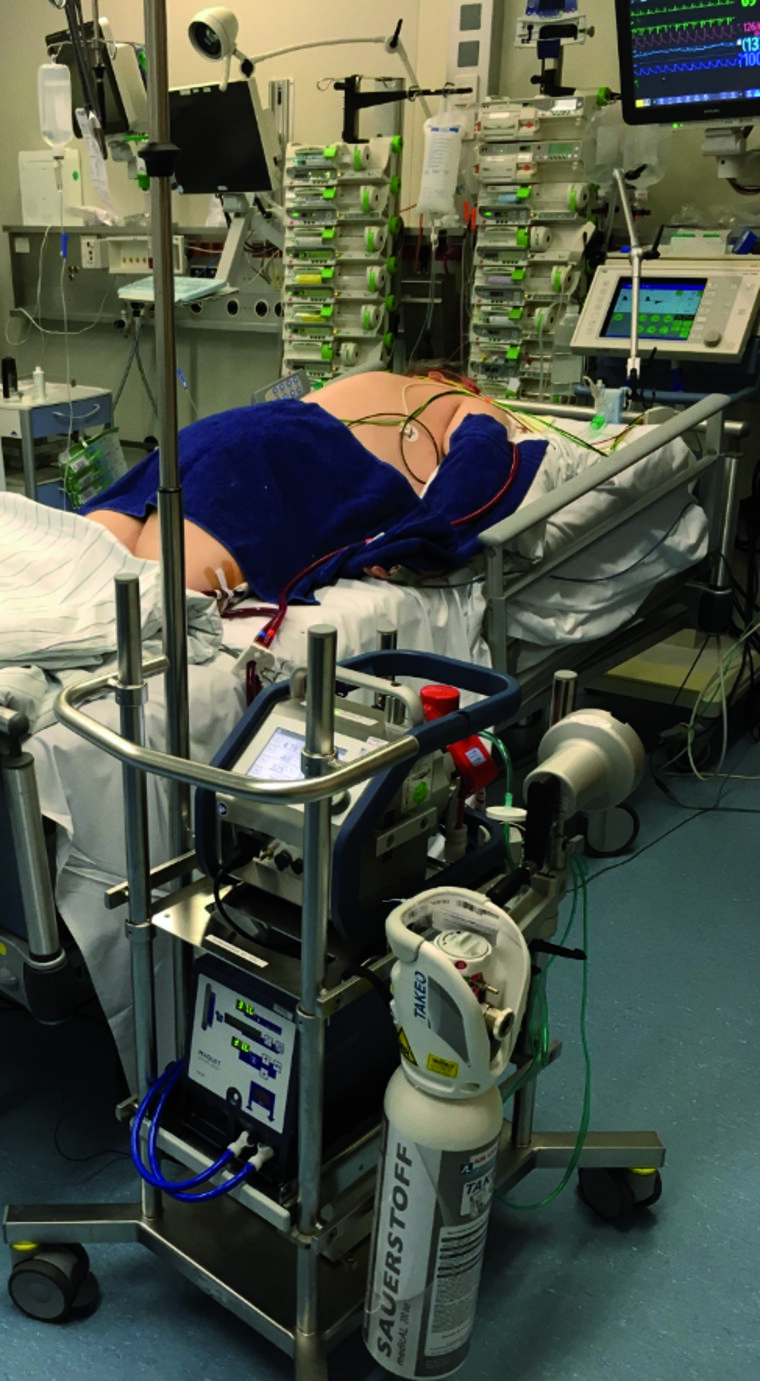
Abb. 1: Patient in Bauchlage mit laufender ECMO (Cardiohelp® der Fa. Maquet) auf der operativen Intensivstation des BwZKrhs Koblenz
ARDS-Therapiekonzepte – Vor und Nachteile
Im Rahmen der ARDS-Therapie wurden verschiedenste Therapiekonzepte wissenschaftlich aufgearbeitet. Vorteile ergaben sich hierbei z. B. für die lungenprotektive Beatmung mit niedrigen Tidalvolumina [6], die Bauchlage [5][9][12] sowie die neuromuskuläre Blockade [17][23].
Eine lungenprotektive Beatmung im Rahmen einer konservativen ARDS-Therapie kann neben den vorteilhaften Effekten auf die Oxygenierung auch nachteilige Effekte auf andere Organsysteme haben. So kann eine angepasste lungenprotektive ARDS-Beatmung zu einem Anstieg des intrathorakalen Druckes und des pulmonal-arteriellen Widerstandes führen und somit eine Rechtsherzbelastung bis hin zum Zirkulationsversagen verursachen [13]. Eine verminderte Herzleistung führt zu einer notwendigen Steigerung der Katecholamin-Therapie, was die Sauerstoffversorgung des Gewebes verschlechtert und somit einen Circulus vitiosus auslöst und nicht selten zum Multi-Organ-Versagen (MOV) führt. Die ECMO-Therapie sorgt für eine adäquate Oxygenierung sowie Decarboxylierung. Dies ermöglicht es, die Beatmungstherapie sowie das Katecholaminregime zu deeskalieren und fängt somit einen Teil der Nebenwirkungen einer konventionellen ARDS-Intensivtherapie ab [1][10].
Studienlage zur ECMO
CESAR-Trial
Beschäftigt man sich heutzutage mit der ECMO-Therapie bei Erwachsenen mit ARDS, so ist es unerlässlich, die zwei wichtigsten Studien der letzten Jahre zu dieser Thematik zu kennen. Die erste Studie: „Conventional Ventilatory Support vs Extracorporeal Membrane Oxygenation for Severe Adult Respiratory Failure“ (der sogenannte CESAR-Trial) beschäftigte sich mit der Frage nach einer Mortalitätsreduktion bei ARDS-Patienten und wurde 2009 publiziert [19]. Hier waren 180 Patienten mit schwerem Lungenversagen einer ECMO-Gruppe oder einer Kontrollgruppe mit konventioneller Ventilation zugeteilt worden. Eingeschlossen wurden Patienten mit einem Lung-Injury-Score > 3,0 oder einer unkompensierten Hyperkapnie mit einem pH < 7,2. Der primäre Endpunkt „Tod oder schwere Behinderung nach 6 Monaten“ wurde in der ECMO-Gruppe bei 37 %, in der Kontrollgruppe bei 53 % (p = 0,03) erreicht. Damit wurde erstmals an erwachsenen Patienten ein Vorteil zugunsten einer ECMO-Behandlung gezeigt.
Allerdings weist das Design der Studie Mängel auf; unter anderem wird kritisiert, dass 22/90 Patienten zwar der ECMO-Gruppe zugeteilt wurden, jedoch aufgrund rascher Besserung oder Tod keine ECMO erhielten. Zudem wurden die Patienten der Kontrollgruppe nach individuellen Vorstellungen in den teilnehmenden Kliniken behandelt, weshalb nur in 70 % eine protektive Beatmung durchgeführt wurde. Alle Patienten der ECMO-Gruppe wurden für die Intervention nach Leicester (UK) gebracht, sodass zudem ein Bias durch die Verlegung in ein spezialisiertes Zentrum anzunehmen ist.
EOLIA-Trial
Wegen der Mängel im CESAR-Trial wurde eine internationale, multizentrisch-randomisierte Studie, „Extracorporeal Membrane Oxygenation for Severe Acute Respiratory Distress Syndrome“ (der sogenannte EOLIA-Trial) aufgelegt und 2018 publiziert [8]. COMBES und seine mitarbeitenden Kollegen schlossen über 6 Jahre 249 Patienten in die randomisierten Arme ECMO- und CMV- (conventional mechnical ventilation) Therapie ein. Ziel der Studie war es, eine Reduktion der Mortalität bei ARDS-Patienten von mindestens 20 % zu erreichen. Im Gegensatz zum CESAR-Trial wurde strikt auf standardisierte Vorgehensweisen in den jeweiligen Therapie-Schenkeln geachtet. Nachdem 75 % der Patienten eingeschlossen waren, zeigte sich, dass das geplante Ziel nicht erreicht werden konnte und die Studie wurde abgebrochen.
Es ergab sich eine Reduktion der Mortalität in der ECMO- gegenüber der CMV-Gruppe von 11 %, allerdings ohne statistische Signifikanz, dennoch mit einem Trend zum Nutzen der ECMO-Therapie. Darüber hinaus ist der Hauptkritikpunkt an der Studie, dass auf Anordnung der betreuenden Ärzte des CMV-Armes bei 28 % aller Patienten aus dieser Gruppe während der Behandlung ein Therapiewechsel hin zur ECMO-Gruppe vollzogen wurde. Somit erscheint ein Vergleich der beiden Kollektive wenig sinnvoll. Doch gerade dieser o. g. Schwachpunkt ist unserer Meinung nach die größte Stärke dieser Arbeit. Es ist bemerkenswert, dass die betreuenden Ärzte bei 28 % der CMV-Patienten unter konservativer Therapie, die alle von Experten auf dem Fachgebiet der konventionellen Beatmungstherapie bei ARDS erhobenen Standards berücksichtigte, keine Überlebenschancen sahen. Sie sahen deshalb, basierend auf ihrer medizinischen Expertise, die ECMO als Ultima-Ratio-Therapie an. In Anbetracht des hohen Prozentsatzes (28 %) von Therapieumstellungen kann man postulieren, dass basierend auf den heutigen internationalen, intensivmedizinisch und herzchirurgischen Fachstandards der praktizierenden Ärzte Erwachsenen mit ARDS deutlich bessere Überlebenschancen unter Verwendung einer modernen ECMO-Therapie eingeräumt werden – ein starkes Signal in Punkto ECMO-Therapie und Überleben bei ARDS-Patienten.
Zur ECMO-Therapie
Funktionsweise der ECMO- Therapie
Moderne ECMO-Systeme zeichnen sich durch ein kompaktes Design aus. Prinzipiell ist zu unterscheiden zwischen einem Verfahren mit (venovenöse-ECMO, vv-ECMO) und ohne Pumpensystem (interventional Lung Assist, iLA). Die iLA-Verfahren werden im Weiteren nicht weiter berücksichtigt, da die für diese Verfahren vorliegende Indikation durch die Systeme mit Pumpensystem auch abgedeckt werden. Bei schwerem hypoxischem Lungenversagen steht die Verbesserung der Oxygenierung im Vordergrund, bei Vorliegen einer schweren respiratorischen Azidose liegt der Fokus auf Kohlendioxid-Elimination. Hier reicht ein geringerer Blutfluss aus, die sogenannte „low flow“-ECMO.
Heutiger Standard bei vv-ECMO-Systemen sind Zentrifugal- oder Axialpumpen, ein plasmaresistenter Poly-Methyl-Penten-Diffusions-Membran-Oxygenator sowie eine Wärmetauscheinheit. Die Kanülierung erfolgt in der Regel in Seldinger-Technik über die rechte oder linke Vena femoralis. Hierüber wird eine lange, im Durchmesser an die physiologischen Anforderungen passend wählbare Kanüle implantiert, über die venöses Blut zum Oxygenator gelangt. Als rückführendes Gefäß nutzt man meist herznahe, kaliberstarke Venen, wie z. B. die rechts- oder linksseitige Vena subclavia oder Vena jugularis interna. Hier kommen kürzere, eher kleinlumige Kanülen, entsprechend den physiologischen Anforderungen frei wählbar, zum Einsatz. Alternativ kann anstelle zweier Kanülen eine Doppellumenkanüle (die sogenannte Avalon-Kanüle) verwendet werden. Diese ist für die Implantation in die rechte Vena jugularis interna entwickelt worden und hat den wesentlichen Vorteil, dass Patienten während der ECMO-Unterstützung mobilisiert werden können, allerdings ist die Anlage technisch aufwendiger. Die systemische Antikoagulation erfolgt mit unfraktioniertem Heparin, wobei die Ziel-aPTT (aktivierte partielle Thromboplastinzeit) in der Regel etwa beim 1,5-fachen der Norm liegt, bei Blutungsneigung auch niedriger.
Indikationen für ECMO-Therapie
Die Indikation für eine vv-ECMO liegt vor, wenn trotz Ausschöpfung aller konservativen Therapiemöglichkeiten eine lebensbedrohliche Hypoxämie vorliegt (Tabelle 2).
Tab. 2: Indikationen für eine vv-ECMO-Therapie
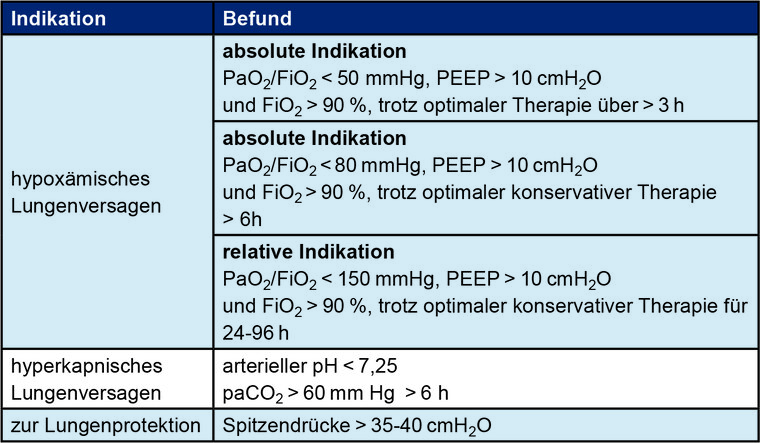
Neben dem Einsatz der ECMO bei hypoxämischem Lungenversagen (Parameter siehe Tabelle 2) besteht eine weitere Indikation bei persistenter Hyperkapnie mit respiratorischer Azidose (arterieller pH < 7,25, paCO2 > 60 mm Hg über > 6 h) im Rahmen der lungenprotektiven Beatmung. Darüber hinaus muss bei manchen Patienten mit ARDS eine invasive, aggressive, nicht den Kriterien einer lungenprotektiven Ventilation entsprechenden Beatmung mit hohen Inspirationsspitzendrücken und hohen Unterstützungsdrücken > 15 cmH2O erfolgen, um eine adäquate Oxygenierung zu ermöglichen. In diesen Fällen ist eine anhaltende Verschlechterung des Patienten durch Zunahme des beatmungsassoziierten Lungenschadens zu befürchten, weshalb hier der frühzeitige Einsatz einer ECMO-Therapie zur Lungenprotektion diskutiert werden kann [5][7].
Kontraindikationen für ECMO-Therapie
Wesentliche Kontraindikationen sind potenziell zeitnahe zum Tode führende, nicht therapierbare Grunderkrankungen, Blutungen im ZNS sowie der kardiogene Schock. Beim kardialem Schockgeschehen kann auf ein veno-arterielles ECLS-Verfahren („extracorporeal life support“) gewechselt werden. Hierbei wird das gleiche System mit dem gleichen Setting wie für die ECMO-Therapie verwendet. Lediglich die Zuführung des arterialisierten Blutes erfolgt nun über eine arteriell eingebrachte, kleinlumige Kanüle. Somit unterstützt bzw. ersetzt die Maschine dann Herz und Lunge.
Bei Indikationsstellung zur ECMO-Therapie sollte berücksichtigt werden, dass die ECMO-Therapie selbst zu keiner Besserung der Grunderkrankung führt, sondern lediglich vorübergehend den Gastransfer unterstützt und somit eine Deeskalation der Katecholamintherapie bzw. der Beatmungsparameter hin zur Lungenprotektion ermöglicht und hilft, Zeit bis zu einer Erholung des erkrankten Organs („bridge to recovery“) oder bis zu einer organersetzenden Therapie („bridge to transplant“) zu gewinnen, die gegebenenfalls für die Organheilung nötig ist. Als Kontraindikation wird daher auch eine terminale Lungenerkrankung ohne Aussicht auf zeitnahe Lungentransplantation angesehen. Eine vorausgehende Langzeitbeatmung (FiO2 > 90 %; Pinsp >30cmH20 für >7Tage) sowie Begleiterkrankungen, wie Leberzirrhose oder chronisch-terminales Nierenversagen, verschlechtern die Prognose erheblich und bedürfen einer patientenindividuellen Entscheidung. Bei Kontraindikationen für eine Antikoagulation ist der Einsatz einer längerfristigen ECMO-Therapie schwer möglich, beziehungsweise sorgfältig abzuwägen.
Komplikationen bei der ECMO-Therapie
Trotz modernster Technik bleiben ECMO-Systeme invasive Verfahren zur Anwendung beim kritisch kranken Patienten mit potenziell lebensbedrohlichen Komplikationen. Verlässliche wissenschaftliche Daten zu Komplikationsraten findet man wenig. Ein Überblick aus dem ELSO-Register findet sich bei BRODIE et al [5].
Im Einzelnen unterscheidet man zwischen vaskulären Komplikationen (wie Gefäßverletzung, Blutung, Thrombose, Embolie) und ECMO-bedingten Risiken, entweder technischer Art, wie Oxygenator-Clotting, Hämolyse, Diskonnektion oder Dislokation sowie Infektion, oder mit systemischen Auswirkungen auf den Patienten, wie z. B. Blutung, heparininduzierte Thrombopenie (HIT) oder disseminierte intravasale Koagulopathie (DIC).
Wehrmedizinische Relevanz der ECMO
Im Rahmen von wiederkehrenden lungenerkrankungs-assoziierten Epidemie- bzw. Pandemie-Wellen – wie aktuell COVID-19 – werden selbst gut ausgestattete Gesundheitssysteme an den Rand ihrer Leistungsfähigkeit gebracht. Der durch die Bundeswehr durchgeführte entlastende Patiententransport aus Italien und Frankreich in deutsche Kliniken zeigte eindrücklich, wie wertvoll die Expertise des Personals der Bundeswehrkrankenhäuser (Bw(Z)Krhs) im Umgang mit ARDS-Patienten im Rahmen des strategischen Lufttransports (StratAirMedEvac) ist.
Die Auslöser eines ARDS bei Soldaten im Einsatz sind ebenso vielfältig. Die Folgen eines schweren Thoraxtraumas nach Explosions- oder Schussverletzung treten zeitlich versetzt ein, sind jedoch potenziell tödlich. Eine Auswertung des Afghanistaneinsatzes der Jahre 2005 bis 2011 ergab, dass von 25 Soldaten, die eine Explosionsverletzung der Lunge erlitten hatten, 14 im weiteren Krankheitsverlauf die Diagnosekriterien eines ARDS erfüllten [4]. Auch schwere Infektionen der Lunge, wie Influenza (letzter Influenza-B Ausbruch 2020 bei US-Streitkräften im Bereich des TAAC N, RSM) oder atypische Pneumonien, treten nicht selten bei Soldaten im Einsatz auf. Weitere Auslöser für ein akutes Lungenversagen können eine nicht pulmonale Sepsis, die transfusionsassoziierte Lungenschädigung (TRALI), das Beinahe-Ertrinken oder schwerste Verbrennungen sein.
Im Jahr 2005 stellte das US-Amerikanische Verteidigungsministerium das „Acute Lung Rescue Team“ (ALeRT) auf, welches über verschiedene extrakorporale Unterstützungssysteme, inklusive ECMO, verfügte. Im Zeitraum von 2005 bis 2011 wurde das Team 40-mal aktiviert und repatriierte 24 Patienten aus Kriegsgebieten nach Deutschland [11]. In der Literatur finden sich u. a. Fallberichte von ECMO-Einsätzen zur Repatriierung aus Afghanistan [14][15]. Durch die räumliche Stationierung des Teams in Deutschland am „Landstuhl Regional Medical Center“ war eine schnelle Erreichbarkeit der Krisenregionen in Europa, Afrika und dem Mittleren Osten gewährleistet. Durch eine interne Umstellung wurde die ECMO-Fähigkeit im Jahr 2014 im „San Antonio Military Medical Center“ (SAMMC) zentriert und steht den US-Streitkräften in Mitteleuropa nicht mehr zur Verfügung.
Im Konzept über die Verfahren im StratAirMedEvac ist eine Repatriierung von schwerverletzten Soldaten innerhalb von 24 Stunden nach Verwundung vorgesehen. Die Entwicklung eines ARDS im Einsatzland ist unter Einhaltung dieser Zeitlinien unwahrscheinlich. Berücksichtigt man aber Einsätze mit mehreren kleineren Verbänden und reduzierter Lufttransportkapazität oder Marineeinsätze mit dem oft daraus resultierenden verzögerten Erreichen einer speziellen intensivmedizinischen Behandlungseinheit („delayed evacuation care“), ist die Entwicklung eines ARDS nach den o.g. Auslösern deutlich wahrscheinlicher, da sich die Zeitlinie der Rettungskette verlängert.
Bei Verwundeten mit schwerem ARDS kann die Repatriierung im Flächenflugzeug mit einer Kabinendruckhöhe von rund 8 000 ft aufgrund der mit dem ARDS verbundenen hochgradigen Oxygenierungsstörung problematisch werden. Kann eine höhenphysiologisch bedingte Verringerung des alveolären Sauerstoffpartialdrucks (Gesetz von Dalton) nicht durch die Erhöhung der inspiratorischen Sauerstofffraktion kompensiert werden, droht eine kritische Hypoxämie. In diesen Fällen bietet die ECMO-Therapie eine sinnvolle Option.
Es lässt sich festhalten, dass die Etablierung und der Ausbau der ECMO-Kapazitäten am BwZKrhs Koblenz bereits jetzt ein wichtiger Faktor im Kontext zukünftiger Herausforderungen bei der Repatriierung verwundeter Soldaten sind. Die ECMO-Fähigkeit sollte aus unserer Sicht zukünftig im Portfolio von StratAirMedEvac-Optionen enthalten sein.
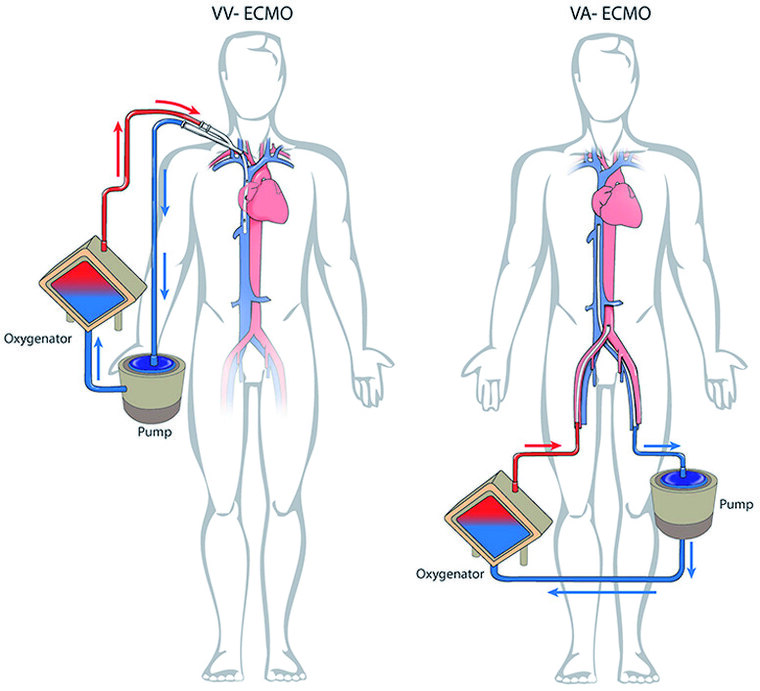
Abb. 2: Schemazeichnung zur Technik der va- und vv-ECMO (Abbildung aus [24])
Aktuelle Datenlage im BwZKrhs Koblenz
Seit der Etablierung der Klinik für Herzchirurgie im BwZKrhs im Jahr 1995 gehört auch die ECMO-Therapie zu einem Standard-Verfahren. Das BwZKrhs Koblenz behandelt im Jahr etwa 50 Patienten mit akutem Lungenversagen. Dank eines hochspezialisierten interdisziplinären ECMO-Teams, bestehend aus Fachärzten für Herzchirurgie, Anästhesie und Intensivmedizin, Kardiologie sowie Kardiotechnikern, verfügt das BwZKrhs Koblenz über eine leistungsstarke ECMO-Abteilung mit derzeit 6 ECMO-/ECLS-Geräten der Firmen Gettinge® und LivaNova®.
Nach gängigen Leitlinien und Expertenmeinung wird Kliniken mit ECMO-Fähigkeit eine Mindestanzahl von 20 Anwendungen pro Jahr empfohlen. Zurzeit versorgt das BwZKrhs Koblenz im Schnitt 30 Patienten pro Jahr mit einer ECMO-/ECLS-Einheit.
Seit 2017 verfügt unser Krankenhaus über ein „out-of-hospital“ (OOH) ECMO-Team. Nach entsprechender Alarmierung und Befundvalidierung ist ein Ausrücken in umliegende Krankenhäuser innerhalb von 10 Minuten möglich. Vor Ort wird der Patient gesichtet, medizinisch triagiert und gegebenenfalls eine „ex domo“-ECMO-Therapie mit nachfolgender Intensivverlegung in das BwZKrhs Koblenz begonnen.
Entwicklung über die Zeit
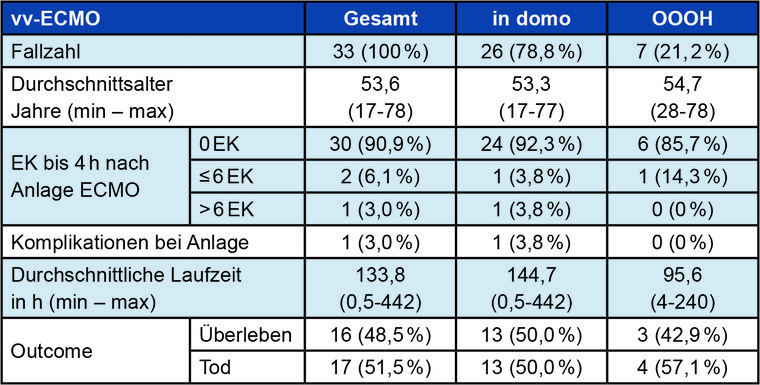
Am BwZKrhs Koblenz wurden in den Jahren 2016 bis 2019 insgesamt 93 ECMO-/ECLS-Patienten versorgt (35,5 % (n = 33) ECMO und 64,5 % (n=60) ECLS). In 18 Fällen wurde das OOH-ECMO-Team alarmiert, in 75 Fällen wurde das Verfahren „in domo“ begonnen. Für diesen Beitrag wurden lediglich Patienten mit isoliertem ECMO-Bedarf ohne primär oder sekundär nachgeschaltetem ECLS-Bedarf ausgewählt (insgesamt 33 Patienten). Bei diesen war die Hauptdiagnose ARDS (n = 29). Drei Patienten hatten aufgrund eines Traumas ein respiratorisches Globalversagen entwickelt. Ein Patient erlitt nach komplexer Lungenoperation ein Lungenversagen. Bei 21,2 % (n = 7) erfolgte die Implantation der ECMO-Einheit durch das OOH-Team.
72,7 % (n = 24) der Patienten waren Männer, 27,3 % (n = 9) Frauen. Anlagebedingte Komplikationen gab es in lediglich einem Fall (3 %), hier allerdings bedingt durch massiv erhöhten BMI und beidseits eingebluteten Leisten. Generell lag der anlagebedingte Verbrauch von Erythrozyten-Konzentraten (EK) sehr niedrig. 90,9 % aller Patienten benötigten keine Bluttransfusion zur Stabilisierung nach ECMO-Einbau.
Führende Todesursache war ein, zumeist von einem septischen Geschehen verursachtes, Multi-Organ-Versagen (MOV) mit 70,6 % (n = 12), gefolgt von therapierefraktären Lungengerüsterkrankungen mit 17,6 % (n = 3). 11,8 % (n = 2) der Patienten verstarben an einer disseminierten intravasalen Gerinnungsstörung und daraus resultierenden Blutungskomplikationen. 48,5 % (n = 16) aller Patienten überlebten den intensivmedizinischen Aufenthalt. In der OOH-Gruppe lag das Überleben bei 42,9 % (n = 3) – bei allerdings sehr kleinem Patientengut –, in der „in domo“-Gruppe überlebten 50 % (n = 13) der Patienten (Tab. 3).
Tab. 3: Übersicht über die vv-ECMO-Daten des BwZKrhs Koblenz von 2016 - 2019
Diskussion und Fazit
Durch den Einsatz modernster Techniken und Materialien verfügen die ECMO-Geräte heutzutage über ein kompaktes Design mit geringer Fremdoberfläche. Plasmadichte Gasaustauschfasern und strömungsoptimierte Blutpumpen mit guter Langzeitfunktion verringern das Blutzelltrauma entscheidend, wodurch Langzeitanwendungen über Wochen möglich werden.
Abb. 3: Oxygenatoreinheit einer ECMO (Fa. Maquet)
Extrakorporale Lungenunterstützungsverfahren sind bei adäquater Indikationsstellung und unter Einhaltung der Therapiestandards ein ergänzendes Therapieverfahren bei der intensivmedizinischen Behandlung von ARDS-Patienten. Während einerseits die Effektivität des Verfahrens in Bezug auf den Gastransfer gut belegt ist, muss andererseits ein hohes Maß an Aufmerksamkeit auf potenziell gravierende Komplikationen gerichtet werden. Technische oder klinische Probleme können akut lebensbedrohlich sein, so dass Erfahrung und interdisziplinäre Zusammenarbeit wesentlich sind.
Die wissenschaftliche Studien- und Datenlage ist bisher nicht sehr umfangreich. Eine eindeutige Einordnung der ECMO-Therapie, bzw. die Ermittlung ihres Stellenwertes ist deshalb heutzutage noch nicht möglich. Die aufgearbeiteten Daten aus dem BwZKrhs Koblenz decken sich weitgehend mit der Datenlage in der bisher zugänglichen Fachliteratur.
Fazit
Die ECMO-Therapie kann bei ARDS-Patienten mit lebensbedrohender Hypoxie den Gastransfer sichern und somit ein Zeitfenster zur Therapie der Grunderkrankung öffnen. Wichtig hierbei sind der standardisierte, zeitlich rechtzeitige Einsatz des Systems sowie eine lungenprotektive Ventilation mit kleinen Tidalvolumina, reduziertem Beatmungsdruck und angepasster inspiratorischer Sauerstoffkonzentration.
Noch wesentlicher und somit essenziell für den Erfolg der ECMO-Therapie ist die Verfügbarkeit von herzchirurgischem wie kardiotechnischem Wissen sowie ein interdisziplinäres ECMO-Team mit Experten aus Herzchirurgie und Kardiotechnik, Anästhesie, Intensivmedizin und Kardiologie. Auch sollte eine jährliche Mindestanzahl von 20 ECMO-Therapien unserer Meinung nach nicht unterschritten werden. Bei adäquater Anwendung der ECMO-Therapie werden die Nebeneffekte einer konventionellen Beatmungstherapie abgeschwächt und beatmungsinduzierte Lungenschäden minimiert.
In Zusammenschau aller Daten und unter Einbeziehung unserer Expertise sind wir der Meinung, dass unter den o. g. Voraussetzungen durch eine ECMO-Therapie das Überleben der Patienten günstig beeinflusst werden kann.
Diese Artikelserie wird in den nächsten Ausgaben fortgesetzt mit einem Beitrag zur Implementierung einer ECMO-Fähigkeit in das StratAirMedEvac-System der Bundeswehr und einer Kasuistik zum externen Einsatz des herzchirurgischen Notfallteams.
Literatur
- Agerstrand CL, Bacchetta MD, Brodie D. ECMO for adult respiratory failure: current use and evolving applications. ASAIO J 2014; 60: 255-262. mehr lesen
- Andrews AF, Roloff DW, Bartlett RH. Use of extracorporeal membrane oxygenators in persistent pulmonary hypertension of the newborn. Clin Perinatol 1984; 11: 729-735. mehr lesen
- Bartlett RH, Andrews AF, Toomasian JM, et al. Extracorporeal membrane oxygenation for newborn respiratory failure: forty-five cases. Surgery 1982; 92: 425-433. mehr lesen
- Braun M, Goldmann K: Das primäre Explosionstrauma der Lunge - Erfahrungen der operativen Intensivstation des Bundeswehrzentralkrankenhauses Koblenz aus sechs Jahren Afghanistaneinsatz. WMM 2015; 59(11): 334-339. mehr lesen
- Brodie D, Bacchetta M: Extracorporeal membrane oxygenation for ARDS in adults. N Engl J Med 2011; 365(20): 1905–1914. mehr lesen
- Brower RG, Matthay MA, Morris A, et al. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med 2000; 342: 1301-1308. mehr lesen
- Combes A, Bacchetta M, Brodie D, Müller T, Pellegrino V: Extracorporeal membrane oxygenation for respiratory failure in adults. Curr Opin Crit Care 2012; 18: 99–104. mehr lesen
- Combes A, Hajage D, Cappelier G, et al.: Extracorporeal Membrane Oxygenation for Severe Acute Respiratory Distress Syndrome. N Engl J Med. 2018 May 24; 378(21): 1965-1975. mehr lesen
- Dalton HJ. There and back again: does prone positioning have any value in respiratory failure? Crit Care Med 2002; 30: 1658-1659. mehr lesen
- Fan E, Gattinoni L, Combes A, et al. Venovenous extracorporeal membrane oxygenation for acute respiratory failure: A clinical review from an international group of experts. Intensive Care Med 2016; 42: 712-724. mehr lesen
- Fang R, Allan PF, Womble SG et al.: Closing the “care in the air“ capability gap for severe lung injury: the Landstuhl Acute Lung Rescue Team and extracorporeal lung support. The Journal of Trauma 2011; 71(1): 91–97. mehr lesen
- Gattinoni L, Marini JJ: Prone positioning and neuromuscular blocking agents are part of standard care in severe ARDS patients: we are not sure. Intensive Care Med 2015; 41: 2201-2203. mehr lesen
- Greyson CR: Pathophysiology of right ventricular failure. Crit Care Med 2008; 36(1 Suppl): S57-65. mehr lesen
- Hamm MS, Sams VG, DellaVolpe JD et al. Case Report of Extracorporeal Membrane Oxygenation and Aeromedical Evacuation at a Deployed Military Hospital. Military Medicine 2018; 183(S1): 203–206. mehr lesen
- Mohamed AT, Maraqa T, Bacchetta MD et al.: The Feasibility of Venovenous ECMO at Role-2 Facilities in Austere Military Environments. Military Medicine 2018; 183(9-19): e644-648. mehr lesen
- Müller T, Bein T, Phillipp A et al.: Extracorporeal Pulmonary Support in Severe Pulmonary Failure in Adults: A Treatment rediscovered. Dtsch Arztebl Int 2013; 110(10): 159-166. mehr lesen
- Papazian L, Forel JM, Gacouin A, et al. Neuromuscular blockers in early acute respiratory distress syndrome. N Engl J Med 2010; 363(12): 1107-1116. mehr lesen
- Park PK, Dalton HJ, Bartlett RH. Point: Efficacy of extracorporeal membrane oxygenation in 2009 influenza A(H1N1): sufficient evidence? Chest 2010; 138: 776-778. mehr lesen
- Peek GJ, Mugford M, Tiruvoipati R, et al.: Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled trial. Lancet 2009; 374: 1351–63. mehr lesen
- Pham T, Rubenfeld GD: Fifty Years of Research in ARDS. The Epidemiology of Acute Respiratory Distress Syndrome. A 50th Birthday Review. Am J Respir Crit Care Med 2017; 195(7): 860-870. mehr lesen
- Randolph AG, Vaughn F, Sullivan R, et al. Critically ill children during the 2009-2010 influenza pandemic in the United States. Pediatrics 2011; 128: e1450-1458. mehr lesen
- Rubenfeld GD, Caldwell E, Peabody E, et al.: Incidence and outcomes of acute lung injury. N Engl J Med 2005; 353: 1685–1693. mehr lesen
- Schmidt M, Bailey M, Sheldrake J, et al. Predicting survival after extracorporeal membrane oxygenation for severe acute respiratory failure. The Respiratory Extracorporeal Membrane Oxygenation Survival Prediction (RESP) score. Am J Respir Crit Care Med 2014; 189: 1374-1382. mehr lesen
- Squiers JJ, Lima B, DiMaio JM: Contemporary extracorporeal membrane oxygenation therapy in adults: Fundamental principles and systematic review of the evidence. J Thorac Cardiovasc Surg 2016; 152(1): 20-32. mehr lesen
- Sud S, Friedrich JO, Adhikari NK, et al. Effect of prone positioning during mechanical ventilation on mortality among patients with acute respiratory distress syndrome: a systematic review and meta-analysis. CMAJ 2014; 186: E381-390. mehr lesen
- The ARDS Definition Task Force: Acute Respiratory Distress Syndrome: The Berlin Definition. JAMA 2012; 307(23): 2526–2533. mehr lesen
- Vasilyev S, Schaap RN, Mortensen JD: Hospital survival rates of patients with acute respiratory failure in modern respiratory intensive care units: an international, multicenter, prospective survey. Chest 1995; 107(4): 1083–1088. mehr lesen
- Villar J, Blanco J, Añón JM, et al.: The ALIEN study: incidence and outcome of acute respiratory distress syndrome in the era of lung protective ventilation. Intensive Care Med 2011; 37(12):1932–1941. mehr lesen
- Zapol WM, Snider MT, Hill JD, et al. Extracorporeal membrane oxygenation in severe acute respiratory failure. A randomized prospective study. JAMA 1979; 242: 2193-2196. mehr lesen
Manuskriptdaten
Zitierweise
Meyer-Oschatz F, Endlich M, Feyrer R, Bredenkötter D, Schmidbauer W, Jänig CW: Wehrmedizinische Relevanz der Extrakorporalen Membranoxygenierung (ECMO) – Teil I: Zur Rolle der ECMO auf den Intensivstationen des Bundeswehrzentralkrankenhauses Koblenz. WMM 2020; 64(10-11): 389-395.
Für die Verfasser
Flottillenarzt Dr. Christoph W. Jänig
Bundeswehrzentralkrankenhaus Koblenz
Klinik X – Anästhesie, Intensivmedizin und Notfallmedizin
Rübenacher Str. 170, 56072 Koblenz
E-Mail: christophwalterjaenig@bundeswehr.org
Manuscipt data
Citation
Meyer-Oschatz F, Endlich M, Feyrer R, Bredenkötter D, Schmidbauer W, Jänig CW: Relevance of ECMO in military medicine – part I: The role of ECMO in intensive care at the Bundeswehr Central Hospital KoblenzWMM 2020; 64(10-11): 389-395.
For the authors
Commander (Navy) Dr. Christoph W. Jaenig, M.D.
Bundeswehr Central Hospital Koblenz
Department X – Anaesthesiolgy, Intesive Care, Emergency Medicine
Rübenacher Str. 170, D-56072 Koblenz
E-Mail: christophwalterjaenig@bundeswehr.org
1 Erste Ansätze zur Anwendung eines kardiopulmonalen Bypasses zur Therapie des ARDS reichen zurück in die 1970er Jahre. Ab Anfang des 21. Jahrhunderts nahm die Entwicklung dann einen raschen Fortgang.