Evaluierung eines Point-of-Care-Testsystems
zum schnellen PCR-Nachweis von SARS-CoV-2
(Poster-Abstract)
Katrin Zwirglmaier a, b, Enrico Georgi a, b, Roman Wölfel a, b
a Institut für Mikrobiologie der Bundeswehr, München
b Deutsches Zentrum für Infektionsforschung (DZIF), Standort München
Hintergrund
Die rasante Ausbreitung von SARS-CoV-2 und die Notwendigkeit einer zuverlässigen und zeitnahen Diagnostik stellte insbesondere auch den Marinesanitätsdienst vor enorme Herausforderungen. Im Gegensatz zur Sanitätsbasis Inland, wo Untersuchungsmaterialien innerhalb kurzer Zeit in akkreditierten Laboren mit Hochdurchsatz-Diagnostiksystemen untersucht werden können, ist dies an Bord von Schiffen nur selten möglich.
Kommando Sanitätsdienst der Bundeswehr (Kdo SanDstBw) hat daher vor Nutzung an Bord die Evaluierung des als Point-of-Care-System konzipierten qPCR-Gerätes VitaPCR™ durch das Institut für Mikrobiologie der Bundeswehr (IMB) beauftragt.
Material und Methoden
Bei der Geräteplattform VitaPCR™ handelt es sich um ein kleines, leichtes real-time-PCR-Gerät (Abmessungen 20,5 x16,5 x 15,5 cm, Gewicht: 1,2 kg), das vom Hersteller für den Einsatz in der patientennahen Diagnostik auch außerhalb eines Routinelabors vorgesehen ist. Durch die Möglichkeit zur Nutzung verschiedener Fluoreszenzkanäle ist das Gerät für Multiplex-qPCR-Assays geeignet. Mit dem entsprechenden Reagenzienkit kann unmittelbar nach Entnahme einer naso- oder oropharyngealen Abstrichprobe ohne vorherige Nukleinsäureextraktion innerhalb von 20 min auf SARS-CoV-2 getestet werden. Der Arbeitsablauf ist in Abbildung 1 dargestellt. Im Rahmen einer umfangreichen Evaluierung am IMB wurden in einem vorgegebenen, engen Zeitfenster insgesamt 199 Einzeltestungen durchgeführt.
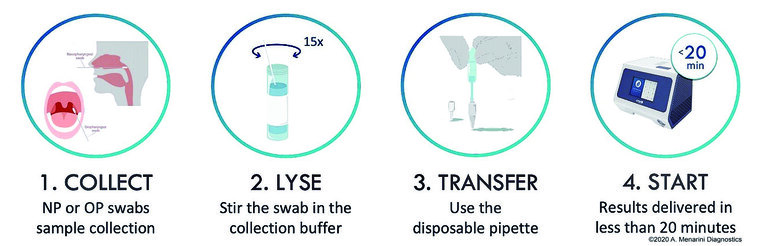
Abb. 1: Untersuchungsgang bei V.a. COVID-19: Über das Touchdisplay des Geräts wird der Benutzer durch die einzelnen Arbeitsschritte geleitet: Probenahme (1), Einrühren des Tupfers in den Probenextraktionspuffer (2), Transfer von 30 μl des Probenextraktionspuffers in das Reaktionsröhrchen mit einer Pipette (3), Scannen des Barcodes auf der Packung des Testkits, Eingabe der Proben-ID, Einsetzen des Röhrchens in das Gerät (4), Start der Analyse. (Bildquelle: ©2020 A. Menarini Diagnostics)
Ausgewählte Ergebnisse
Bestimmung des Detektionslimits
Die Bestimmung des Detektionslimits erfolgte mit hitzeinaktiviertem, exakt quantifiziertem Zellkulturüberstand (ZKÜ) einer SARS-CoV-2-Viruskultur (Stamm IMB-1). Im Gegensatz zu der vom Hersteller durchgeführten Validierung mit In-vitro-Transkripten, die lediglich aus RNA des Zielgens bestehen, enthält der ZKÜ das komplette Virusgenom in (intakten) Viruspartikeln und erlaubt somit eine realistischere Überprüfung des Detektionslimits. Die Messungen erfolgten auf zwei Geräten jeweils im Triplikat. Mittels Probitanalyse konnten die Herstellerangaben zum Detektionslimit weitgehend reproduziert werden.
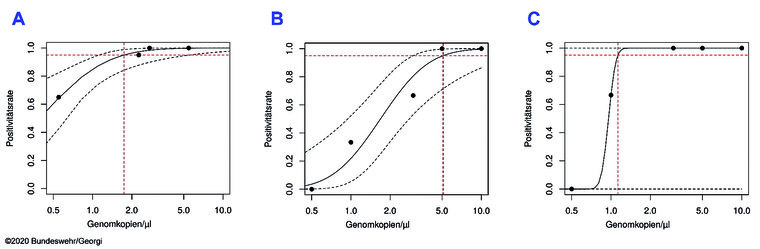
Abb. 2: Plots der Ergebnisse der Probitanalyse: (A) Plot nach Daten des Herstellers (SARS-CoV-2), (B) Daten IMB (SARS-CoV-2), (C) Daten IMB (SARS-like).
Kreuzreaktionen
Es wurden 29 differentialdiagnostisch relevante Erreger (Bakterien, Pilze, Viren) getestet. Dabei wurden keine unspezifischen Kreuzreaktionen festgestellt.
Vergleich zwischen zwei baugleichen Geräten
Die Variationskoeffizienten für SARS-like, SARS-CoV-2 und interne Kontrolle zweier VitaPCR™-Systeme, basierend auf einer jeweils in Triplikaten durchgeführten Verdünnungsreihe über 7 Verdünnungsstufen, wurden bestimmt. Dabei zeigte sich eine gute Übereinstimmung der ermittelten Messwerte zwischen den beiden Geräten.
Vergleich zur stationären Routinediagnostik
Bei vergleichender Testung gegen ein etabliertes PCR-System aus der stationären Routinediagnostik mit standardisiertem SARS-CoV-2-Kulturmaterial und exakt quantifizierten RNA-Präparationen lag die Nachweisgrenze des POCT-Systems nahe an der des Routine-PCR-Systems.
Diskussion und Fazit
Vorteile des für den Point-of-Care-Einsatz getesteten VitaPCR™-Systems sind:
+ einfache Gerätebedienung (kein Fachpersonal notwendig)
+ Testergebnis schnell verfügbar (20 bis 30 Minuten)
+ Nachweisgrenze und Spezifität (SARS-CoV-2-Assay)
+ Datenexport über USB- oder RS232-Schnittstelle möglich
Diesen Vorteilen stehen allerdings einige Nachteile gegenüber:
– nur eine Probe pro Gerät gleichzeitig untersuchbar
– hohe Testkosten pro Probe (ca. 40 EUR)
– nur frische Nasen-/Rachenabstriche geeignet
– Störungen durch Probenmatrix möglich
Aus technischen Gründen sind Proben mit Virustransportmedium nicht mehr für die VitaPCR™ geeignet, so dass eine einfache Nachtestung von Proben aus der Probenbank am IMB nicht möglich war. Aufgrund der zum Evaluierungszeitpunkt im Juni 2020 fehlenden frisch entnommenen Primärmaterialien konnte die klinische Sensitivität nur mittels artifiziellen klinischen Proben (negative Rachenabstriche, gespikt mit ZKÜ) untersucht und somit nur eingeschränkt beurteilt werden.
Zusammengefasst ist auf Basis der in dieser Untersuchung kurzfristig erhobenen Laborergebnisse die Nachweisgrenze des VitaPCR™-Systems durchaus vergleichbar mit einem Routine-PCR-System. Als patientennahes Diagnostikgerät weist die VitaPCR™ im Vergleich zu den ebenfalls am IMB evaluierten Antigenschnelltesten deutlich bessere Leistungsparameter auf. Sie ist aber kein Ersatz, sondern allenfalls eine Ergänzung zu Hochdurchsatz-PCR-Verfahren mit Nukleinsäureaufreinigung im Routinelabor. Wenngleich nicht für den Massendurchsatz geeignet, kann das System bei einzelnen klinischen Verdachtsfällen eine schnelle und zuverlässige Möglichkeit zur Diagnostik insbesondere an Bord schwimmender Einheiten darstellen und bei nicht verfügbarer Routinediagnostik eine gute Entscheidungsunterstützung sein.
Für die Verfasser
Flottillenarzt Enrico Georgi
Institut für Mikrobiologie der Bundeswehr
Neuherbergstr. 11, 80937 München
E-Mail: enrico1georgi@bundeswehr.org
Poster-Präsentation beim 51. Jahreskongress der Deutschen Gesellschaft für Wehrmedizin und Wehrpharmazie e. V. in Rostock-Warnemünde (23.-24. Oktober 2020)