WENN DIE ZEIT DRÄNGT
Schnelldiagnostik einer Strahlenexposition mittels
direktem Nachweis von DNA-Schäden in Blutzellen
Harry Scherthana , Matthias Porta
a Institut für Radiobiologie der Bundeswehr, München
Hintergrund
Strahlenunfälle, der Einsatz von A-Waffen oder terroristische Aktionen, bei denen radioaktive Stoffe freigesetzt werden, bergen das Risiko, dass eine große Anzahl von Personen ionisierender Strahlung ausgesetzt wird. Unfallbedingte Exposition mit höheren Strahlendosen verursacht Schäden an Zellen und Organen, die ein akutes Strahlensyndrom zur Folge haben. Insbesondere wenn die Strahlendosis 2–4 Gray (Gy) übersteigt, erfordert dieses dann oft eine intensive medizinische Betreuung des Patienten [4]. Im Bereich von Strahlenexpositionen mit einer absorbierten Energiedosis von weniger als einem Gy sind direkte klinisch erkennbare Auswirkungen auf den Menschen selten. Allerdings können in diesem Fall Folgeschäden wie Krebsentstehung, aber auch andere langfristige und späte Schädigungen von Organsystemen, z. B. des Herz-Kreislaufsystems, verursacht werden. Insbesondere für solche Fälle ist eine Nachweisführung mittels aufwendiger Biodosimetrie erforderlich [6].
Eine physikalische Dosimetrie nach Strahlenexposition ist oft nur indirekt über Rekonstruktion des Expositionsgeschehens und dem Wissen über die involvierten Quellen möglich und zudem häufig mit Unsicherheiten belegt. Der Strahlenschutz fußt auf der Abschätzung von biologischer Wirksamkeit und den daraus resultierenden Folgen für den betroffen Organismus. Somit sind Kenntnisse von biologischen Endpunkten und Dosiseffekten ein wichtiger Schritt für den initialen Nachweis einer Strahlenexposition und auch für die Risikobewertung in der Nachsorge.
In den meisten Fällen einer realen oder vermuteten akzidentellen Exposition gegenüber ionisierender Strahlung kann die physikalische Dosimetrie häufig nicht oder nur sehr begrenzt (z. B. mittels Elektronenspinresonanz-Untersuchungen von Zahnschmelz oder Knochen) für retrospektive Schätzungen herangezogen werden. In solchen Situationen kann die biologische Dosimetrie, wie sie am Institut für Radiobiologie der Bundeswehr (InstRadBioBw) in München etabliert ist, sowohl zur Schnelldiagnostik als auch zur retrospektiven Dosis-Abschätzung zum Einsatz kommen.
Biologische Dosimetrie
Die klassische biodosimetrische Analyse basiert auf zytogenetischen Endpunkten (Biomarkern), denen eine direkte oder indirekte Quantifizierung von DNA-Doppelstrangbrüchen zugrunde liegt. Diese Biomarker sollten im Idealfall durch ionisierende Strahlung (IR) spezifisch verändert werden. Auch ist die Beziehung zwischen klinischen Prodromi und Energiedosis nach Absorption von IR nicht immer eindeutig: Übelkeit, Erbrechen und Durchfall sind beispielsweise die bekanntesten medizinischen Begleiterscheinungen einer akuten Strahlenexposition, wobei eine genaue Korrelation zwischen solchen Symptomen und der Energiedosis kaum gegeben ist [1]. Relativ zuverlässig für eine Dosisabschätzung hat sich in den letzten Jahren die Auswertung instabiler chromosomaler Aberrationen (z. B. dizentrische Chromosomen) sowie Mikrokernen in kernhaltigen Blutzellen gezeigt, wobei die Dizentrik-Analyse bis heute die am besten validierte und hoch strahlenspezifische Biodosimetrie-Methode darstellt [3][9].
Schnelldiagnostik im Expositionsfall:
Der DSB-Fokus-Assay
Geht es im Falle der (möglichen) Exposition gegenüber IR um die Schnelldiagnostik für die Identifikation und eine erste Einteilung (Triage) von exponierten/nicht-exponierten Betroffenen, hat sich als molekularer Endpunkt der direkte Nachweis von DNA-Schäden in Form mikroskopischer Foci (γ-H2AX Foci) im Zellkern erwiesen [8]. Diese Methode kann schon wenige Minuten nach einer akuten Exposition bis in den Milligray-Bereich eingesetzt werden [13] und ist bei korrekter Anwendung etwa um den Faktor 50 sensitiver als die Dizentrik-Analyse. Die Technik fußt auf einem linearen Zusammenhang zwischen strahleninduzierten DNA-Doppelstrangbrüchen (DSB) und assoziierten mikroskopischen Punkten von DSB-Reparaturproteinen wie γ-H2AX oder 53BP1 im Zellkern von Leukozyten. Dieser Zusammenhang ist über einen Zeitraum von rund einem bis zwei Tagen in Abhängigkeit von der absorbierten Energiedosis erkennbar. Die Foci-Häufigkeiten lassen sich im InstRadBioBw mithilfe eines Fluoreszenzmikroskops nach einem halben Tag Laborarbeit erheben. Die durchschnittlichen Foci-Häufigkeiten geben hierbei Hinweise auf die Höhe einer möglichen Strahlenexposition und können somit eine Triage und das klinische Management strahlenverunfallter oder exponierter Personen unterstützen. Eine Dosisabschätzung ist hierbei allerdings nur möglich, wenn der Zeitpunkt zwischen der fraglichen Exposition und Probennahme bekannt und nicht weiter als 24 Stunden zurück liegt [10]. Ebenso lassen sich mit dem DSB-Fokus-Assay Hinweise auf akute Teilkörperexpositionen, wie sie in Unfallszenarien nicht selten vorkommen, über eine Abweichung von der Normalverteilung auch noch nach 7 Tagen in ca. 70 % der Proben erheben [7].

Abb. 1: Zellkerne (blau) peripherer Blutzellen mit runden DSB-Foci (links) und alpha-Spuren (grün/rot; Mitte unten und rechts oben) nach Bestrahlung mit Radium-223 (223Ra) in Lösung; Immunfluoreszenz-Spezialfärbung gegen die DNA-Doppelstrangbruch-Reparaturproteine γ-H2AX (grün) und 53BP1 (rot)
(Mikroskopvergrößerung im Original 630-fach)
Im Niedrigdosisbereich, wie z. B. nach Aufnahme von Radionukliden oder bei CT-Untersuchungen, liefert der DSB-Fokus-Assay wichtige Hinweise auf Radionuklidinkorporation und externe Expositionen [5][13].
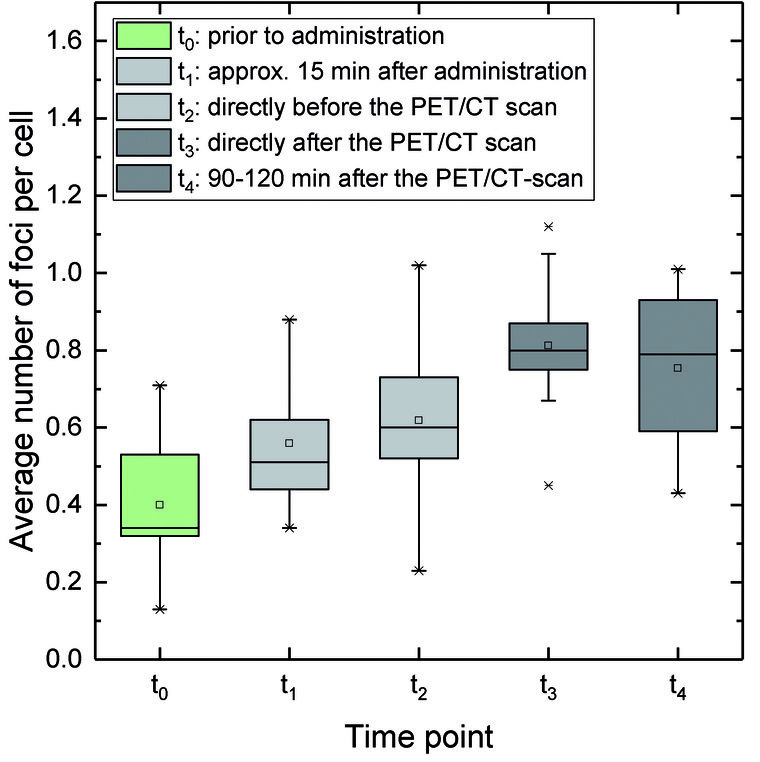
Abb. 2: Anstieg der durchschnittlichen Anzahl von DSB-Foci pro Zelle während der PET/CT Diagnostik: Der Mittelwert der durchschnittlichen Foci Anzahl bei t0 ist signifikant erhöht relativ zu t1 (t1 absorbierte Dosis: 1±0,3 mGy), t2 (1,8±0,3 mGy), t3 (2,1±0,6 mGy68Ga + 11,8±4,7 mGy CT), und t4 (2,7±0,7 mGy68Ga + 11,8±4,7 mGy CT). Die durchschnittliche Anzahl von DSB-Foci stieg durch die interne Positronen-Exposition durch68Ga von t1 zu t2 signifikant an. Der Anstieg von t2 zu t3 zeigt die externe Exposition mit Röntgenstrahlen des CT an. (Abbildung reproduziert aus [13] unter CC-BY 4.0 Lizenz)
Ferner kann auch die DNA-Schadensgeometrie im exponierten Zellkern zur Diskriminierung der Inkorporation von Alpha- und/oder Betastrahler herangezogen werden. So zeigen z. B. mit223Ra in Lösung exponierte kernhaltige Blutzellen typische gamma-H2AX Spuren in den getroffenen Zellkernen (Abbildung 1), die man in beta- und gamma-bestrahlten Zellen kaum beobachtet [12]. Leukozyten, die gegenüber Betastrahlern exponiert wurden, weisen dagegen rundliche und wesentlich kleinere Foci auf (z. B. [2]; Abbildung 1). Untersuchungen bei Prostatakarzinompatienten zeigten jüngst, dass die Alpha-DNA-Schadensspuren-Diagnostik bis in Bereichen von absorbierten Dosen von wenigen mGy informativ ist (Abbildung 3) [11].
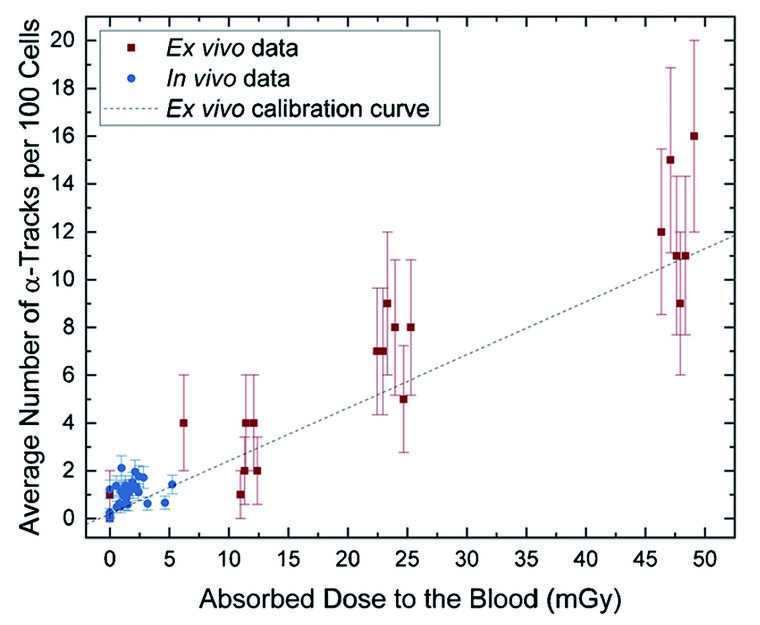
Abb. 3: Durchschnittliche Anzahl von Alpha-DNA-Schadensspuren in Blutproben von223Ra behandelten Prostata-CA Patienten (blaue Symbole; absorbierte Blutdosis ≤ 5mGy) relativ zu Werten von ex-vivo223Ra exponierten Blutproben (rote Symbole) im Bereich bis zu 50mGy absorbierter Dosis (Abbildung reproduziert aus [11] unter CC-BY 4.0 Lizenz)
Fazit
InstRadBioBw hält die Alpha-DNA-Schadensspuren- und DSB-Focus-Diagnostik als schnelle Spezialdignostik vor, um im Falle eines A-Expositionsgeschehens die Med-A-Taskforce und klinische Handlungsentscheidungen in Med A-Lagen zu unterstützen. Mit einer Sensitivität von wenigen mGy kann sie bereits nach einem halben Labortag im niedrigsten Dosisbereich Befunde liefern und sollte als Schnelldiagnoseverfahren in Zukunft zur unmittelbaren Diagnostik nach vermuteter oder tatsächlicher Strahlenbelastung gehören.
Ergebnis erfolgreicher Forschungskooperation
Die Ergebnisse wurden in einer langjährigen exzellenten Zusammenarbeit zwischen dem InstRadBioBw und der Klinik für Nuklearmedizin des Universitätsklinikum Würzburg erzielt – nach Meinung der Autoren ein Musterbeispiel einer effektiven und zielgerichteten zivil-militärischen Forschungskooperation. Insbesondere Prof. M. Laßmann, Dr. U. Eberlein und Dr., S. Schumann von der AG Medizinphysik der Klinik für Nuklearmedizin am Universitätsklinikum Würzburg und deren Leiter, Prof.Dr. A. Buck, gebührt hierfür der ausdrückliche Dank der Autoren.
Literatur
- Abend M, Port M: Contribution of Biodosimetry to Different Medical Issues. Radiat Prot Dosimetry 2019; 186(1): 123-125. mehr lesen
- Eberlein U, Scherthan H, Bluemel C et al.: DNA Damage in Peripheral Blood Lymphocytes of Thyroid Cancer Patients After Radioiodine Therapy. J Nucl Med 2016; 57(2): 173-179. mehr lesen
- Haupt J, Ostheim P, Port M, Abend M: Using Dicentric Dose Estimates and Early Radiation-Induced Blood Cell Count Changes of Real Case Histories for Validation of the Hemodose Biodosimetry Tool. Radiat Prot Dosimetry 2020; 189(4): 428-435. mehr lesen
- Herrmann T, Baumann M, Dörr W: Klinische Strahlenbiologie. Elsevier GmbH: Munich, 2006.
- Kaatsch. HL, Becker BV, Schule S et al.: Gene expression changes and DNA damage after ex vivo exposure of peripheral blood cells to various CT photon spectra. Sci Rep 2021; 11: 12060. mehr lesen
- Kleinerman RA, Romanyukha AA, Schauer DA, Tucker JD: Retrospective assessment of radiation exposure using biological dosimetry: chromosome painting, electron paramagnetic resonance and the glycophorin a mutation assay. Radiat Res 2006; 166: 287-302. mehr lesen
- Lamkowski A, Forcheron F, Agay D et al.: DNA damage focus analysis in blood samples of minipigs reveals acute partial body irradiation. PloS one 2014; 9: e87458. mehr lesen
- Raavi V, Perumal V, Solomon FDP: Potential application of gamma-H2AX as a biodosimetry tool for radiation triage. Mutat Res 2021; 787: 108350. mehr lesen
- Rothkamm K, Beinke C, Romm H et al.: Comparison of established and emerging biodosimetry assays. Radiat Res 2013; 180: 111-119. doi:10.1667/rr3231.1. mehr lesen
- Rothkamm K, Horn S, Scherthan H et al.: Laboratory intercomparison on the gamma-H2AX foci assay. Radiat Res 2013; 180(2): 149-155. mehr lesen
- Schumann S, Eberlein U, Lapa C, Muller J, Serfling S, Lassmann M, Scherthan H: alpha-Particle-induced DNA damage tracks in peripheral blood mononuclear cells of [(223)Ra]RaCl2-treated prostate cancer patients. Eur J Nucl Med Mol Imaging 2021; 48: 2761-2770. mehr lesen
- Schumann S, Eberlein U, Muhtadi R, Lassmann, M.; Scherthan, H. DNA damage in leukocytes after internal ex-vivo irradiation of blood with the alpha-emitter Ra-223. Sci Rep 2018; 8: 2286. mehr lesen
- Schumann S, Scherthan H, Frank T et al.: DNA Damage in Blood Leukocytes of Prostate Cancer Patients Undergoing PET/CT Examinations with [(68)Ga]Ga-PSMA I&T. Cancers 2020; 12(2): 388. mehr lesen
Für die Verfasser
Regierungsdirektor Prof. Dr. Harry Scherthan
Institut für Radiobiologie der Bundeswehr
Neuherbergstr. 11, 80937 München
E-Mail: harryscherthan@bundeswehr.org