EINE ERFOLGREICHE KOOPERATION
Mit mesenchymalen Stammzellen gemeinsam gegen die Folgen einer Strahlenexposition
Tanja Poppa, Julian Haupta,d, Mark Hotza, Viktoria Hüfnerb,c, Markus Rojewskib,c, Benedikt Friemertd,
Hubert Schrezenmeierb,c, Matthias Porta
a Institut für Radiobiologie der Bundeswehr, München
b DRK-Blutspendedienst Baden-Württemberg-Hessen, Institut für Klinische Transfusionsmedizin und Immungenetik Ulm
c Universität Ulm, Institut für Transfusionsmedizin
d Bundeswehrkrankenhaus Ulm, Klinik XIV – Orthopädie/Unfallchirurgie
Hintergrund
Erwiesenermaßen kann Strahlung in der Medizin nicht nur heilen, sondern auch Schaden anrichten. Dies gilt vor allem für ionisierende Strahlung. Eine lokale Strahlenverletzung der Haut bezeichnet man als kutanen Strahlenschaden – international wird auch von „local radiation injury“ (LRI) gesprochen. Dieser entsteht bei akuter und lokal begrenzter Applikation von Dosen ab etwa 3 Gy und ist charakterisiert durch Hautrötungen, subepidermale Blasen sowie nekrotisierende Entzündungen und Ulzerationen, die schlecht abheilen und im weiteren Verlauf auch immer wieder rezidivieren können. Die Therapie der schweren Strahlenschäden der Haut stellt komplexe Anforderungen an alle Beteiligten. Die Behandlung ist sehr langwierig und umfasst häufig chirurgische Maßnahmen mit sukzessiver Exzision, Rekonstruktion oder Amputation [10]. Eine besondere Herausforderung ist die Kontrolle und/oder Unterbrechung der Entzündungsreaktion.
Neben den Begleiterscheinungen bei medizinischem Einsatz von ionisierender Strahlung in der Krebstherapie oder in der Röntgendiagnostik sind unter wehrmedizinischen Aspekten vor allem auch die Folgen einer akzidentellen oder gezielten Exposition mit Strahlung von großem Interesse. Sowohl die Reaktorunglücke von Tschernobyl und Fukushima als auch die sich verändernde Sicherheitslage weltweit im Hinblick auf radiologische und nukleare Szenarien unterstreichen, wie wichtig die Verbesserung bestehender Therapien und die Entwicklung innovativer therapeutischer Verfahren ist.
Stammzellen als Option und Chance
In den letzten Jahren konnten in präklinischen und klinischen Studien die wundheilungsfördernden Eigenschaften von humanen mesenchymalen Stammzellen (hMSCs) bei chronischen Wunden bereits nachgewiesen werden. Für die Therapie der schweren LRI wird neben der dosisgesteuerten chirurgischen Behandlung 1 sowohl von der Weltgesundheitsorganisation (WHO) als auch der internationalen Atomenergiebehörde (IAEA) die Therapie mit hMSCs als Standard angesehen. Vorliegende Ergebnisse beruhen allerdings auf niedrig zweistelligen individuellen Heilversuchen, vorwiegend durch französische Behandlerteams [3][13]. Stammzellen fördern die Angio- und Lymphangiogenese und wirken anti-oxidativ, anti-inflammatorisch sowie anti-fibrotisch [16]. HMSCs werden vorwiegend aus Knochenmark, Fettgewebe, der Plazenta oder der Nabelschnur gewonnen und können in vitro expandiert werden. Diese werden dann direkt dem Patienten zugeführt, indem man sie entweder infundiert, lokal injiziert oder topisch auf die betroffenen Stellen appliziert. Um einen unmittelbaren Einsatz am Patienten gewährleisten zu können, ist der Aufbau von sogenannten Zellbanken von Vorteil. Dort lagern GMP-konform die isolierten Stammzellen in einer Master-Zellbank, aus der dann die benötigte Menge an Zellen vermehrt werden kann (Abbildung 1).
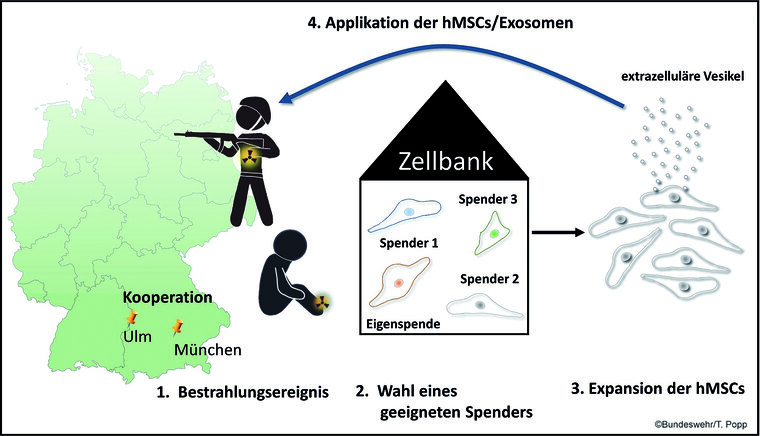
Abb. 1: Prinzip der Stammzell-Therapie kutaner Strahlenschäden (Modell aus der Kooperation München-Ulm):
Kommt es zu einer Strahlenexposition eines Patienten im Rahmen einer Radiotherapie oder zur Exposition eines Soldaten (1.) mit starker Beteiligung der Haut, so kann eine Behandlung mit hMSCs oder von diesen sezernierten extrazellulären Vesikeln erfolgen. Zunächst wird in einer Zellbank nach einem geeigneten Spender gesucht oder es erfolgt eine Eigenspende des Patienten (2.). Anschließend werden die hMSCs expandiert (3.) sowie die Exosomen isoliert und angereichert, bevor sie dann zur klinischen Anwendung kommen (4.).
Etablierung einer Zellbank
Am Institut für Transfusionsmedizin der Universität Ulm und dem Institut für Klinische Transfusionsmedizin und Immungenetik Ulm wurde in den vergangenen Jahren in einer Kooperation ein xenogenfreies System zur Isolation und Expansion von hMSCs entwickelt. Die behördliche Erlaubnis gemäß § 13 Arzneimittelgesetz für diese Form der hMSC-Expansion wurde erteilt, sodass die hergestellten Zelltherapeutika bereits in klinischen Studien zur autologen Knochenreparatur nach Trauma/Knochennekrosen eingesetzt wurden [7][8][15].
Bei der Herstellung derartiger Arzneimittel für neuartige Therapien (Advanced Therapy Medicinal Products, ATMP) konnte bisher noch nicht gänzlich auf den Einsatz von Kulturmedien verzichtet werden. Durch das darin enthaltene fötale Kälberserum (FCS) kommt es damit zum Eintrag von Fremdeiweißen, die potenziell stark immunogen wirken können. Großer Vorteil des etablierten Systems aus Ulm ist, dass auf FCS komplett verzichtet werden kann. Um auch ein Infektionsrisiko durch Komponenten tierischen Ursprungs auszuschließen, wurden Thrombozytenpräparate hergestellt, die als sogenannte Plättchenlysate Wachstumsfaktoren enthalten, von denen bekannt ist, dass sie das Wachstum von hMSCs fördern.
Für den zurzeit laufenden Aufbau einer Zellbank sind mehrere Schritte nötig. Zunächst erfolgte die vollständige Charakterisierung der isolierten Stammzellen. Dies beinhaltet zum einen die Bestimmung stammzellspezifischer Oberflächenmarker wie CD105, CD90, und CD73 mittels Durchflusszytometrie sowie den Nachweis des Differenzierungspotenzials in die osteogene, adipogene und chondrogene Richtung. Im Anschluss wurde die Expansion in einem geeigneten Bioreaktor etabliert, wodurch mittlerweile innerhalb von rund 2–3 Wochen mehrere 100 Millionen Zellen generiert werden können [6].
Die Zellausbeute und Vitalität der Zellen ist insbesondere abhängig vom eingesetzten Medium und der gewählten Beschichtung der Wachstumsoberfläche des Bioreaktors. Das für das Kulturmedium verwendete Plättchenlysat wird aus Thrombozytenkonzentraten von Blutspendern gewonnen. Durch das Paul-Ehrlich-Institut wird gefordert, dass bei der Herstellung von ATMP aus Sicherheitsaspekten so wenig unterschiedliche Spender wie möglich gepoolt werden. Die eingesetzten Medien werden weiter optimiert. Es erfolgte unter anderem die Evaluation eines kommerziell verfügbaren, serum- und xenogenfreien Mediums, um die Menge an benötigtem Plättchenlysat zu reduzieren. Um die stringentesten Wachstumsbedingungen zu erzielen, wurden Kombinationen aus verschiedenen Verhältnissen des Mediums mit Plättchenlysat und dem synthetischen Medium getestet, damit potenziell synergistische Wirkungen bestmöglich ausgenutzt werden können.
Kooperation München-Ulm
Ziel des gemeinsamen Vorhabens des Instituts für Transfusionsmedizin der Universität Ulm und des InstRadBioBw ist es, die immunmodulatorischen und heilungsfördernden Qualitäten der hMSCs auch vor einem radiobiologischen Hintergrund zu betrachten.
Einfluss von Strahlung auf hMSCs
Zunächst ist von Interesse, wie hMSCs auf Strahlung reagieren, wenn sie direkt bestrahlt werden. Sie erwiesen sich dabei als überaus strahlenresistent. Noch bei Dosen von 30–60 Gy überlebten sie in Kultur, waren jedoch in ihrer Proliferations- und Differenzierungskapazität stark eingeschränkt [5].
Im Hinblick auf die Migration der Zellen, die in sogenannten Scratch-Assays untersucht wurde, war keine deutliche Verschlechterung zu beobachten. Allerdings veränderte sich das Zytokin-Profil, das von den Stammzellen sezerniert wurde signifikant. Insbesondere bei Faktoren wie „vascular endothelial growth factor“ (VEGF), die für die Neubildung von Blutgefäßen eine entscheidende Rolle spielen, war ein starker strahlungsinduzierter Rückgang zu messen. Andererseits war eine gesteigerte Sekretion des Wachstumsfaktors „platelet derived growth factor“ (PDGF) detektierbar, der nachweislich zur verbesserten Wundheilung beiträgt [4][9].
Einfluss von Immunmodulatoren
Stammzellen werden durch verschiedene Faktoren wie Zytokine, Thrombomodulin, sowie Komplementfaktoren, die bei der Gewebeschädigung freigesetzt werden, angelockt [12]. Vor Ort tragen die hMSCs auf mehrfache Weise zur Wundheilung bei. Neuere Erkenntnisse belegen, dass hier insbesondere deren immunmodulatorische Kapazität zum Tragen kommt, indem sie die aufflammende Entzündung im Gewebe regulieren. Zum einen wird die Produktion von proinflammatorischen Zytokinen wie TNFa und INF-g im Gewebe abgeschwächt, während andererseits die Sekretion von IL-10 und IL-4, die anti-inflammatorische Wirkung zeigen, verstärkt wird.
Diese Form der Immunmodulation möchte man auch bei bestrahlten Patienten ausnutzen. In mehreren klinischen Fällen wurde bereits eine Zelltherapie mit positiven Effekten durchgeführt. Durch die lokale Stammzelltherapie im Bereich der Wundränder eines Patienten mit schweren radiogenen Hautnekrosen zeigte sich eine beschleunigte Heilung der Defektstelle und kein erneutes Aufflammen einer inflammatorischen Reaktion [2][10]. Auch bei einem anderen Fall mit einer starken Hautschädigung nach Strahlentherapie wurde durch Einspritzen eines Lipoaspirats, welches autologe hMSCs enthielt, signifikante Verbesserung der Hautschädigung bis hin zur vollständigen Abheilung beobachtet [14].
Zellfreie Alternativen
Neben einer direkten Zelltherapie gibt es zellfreie Alternativen. Diese stehen aktuell im Fokus der Forschung am InstRadBioBw. In zahlreichen Zellkultur- und Tiermodellstudien konnte bereits gezeigt werden, dass der positive Effekt der hMSCs auf die Wundheilung vermutlich vor allem über sezernierte Faktoren und extrazelluläre Vesikel vermittelt wird [11][16]. Die extrazellulären Vesikel, zu denen Exosomen, Mikrovesikel und apoptotische Körperchen zählen, enthalten hauptsächlich Proteine, Lipide und RNA, die als Mediatoren der interzellulären Kommunikation dienen [1]. Insbesondere die Exosomen, die eine Größe von 40–150 nm besitzen, spielen hier eine entscheidende Rolle. Zur Isolation der Exosomen wurde am Institut ein Protokoll etabliert, bei dem durch differenzielle Zentrifugation mittels Ultrazentrifuge die Fraktion der Exosomen angereichert wird. Die Vesikel werden dann in funktionellen Untersuchungen der Hautzellen eingesetzt, um den strahleninduzierten Schaden abzumildern. In primären Keratinozyten und primären Fibroblasten, die mit bis zu 30 Gy bestrahlt worden waren, konnte bereits eine Verbesserung des migratorischen Potenzials sowie der Zellviabilität durch therapeutischen Einsatz der extrazellulären Vesikel der hMSCs erreicht werden.
Ausbau des Netzwerks
Derzeit befindet sich ein Forschungsnetzwerk zwischen dem InstRadBioBw, dem Institut für Transfusionsmedizin der Universität Ulm und dem Institut für Klinische Transfusionsmedizin und Immungenetik Ulm sowie der Klinik für Orthopädie und Unfallchirurgie des Bundeswehrkrankenhauses (BwKrhs) Ulm im Aufbau. Die gewonnenen Erkenntnisse dieses Netzwerkes sollen dann in die kontinuierliche Verbesserung der hMSC-Therapie am BwKrhs Ulm einfließen.
Auch im Hinblick auf die wehrmedizinische Relevanz ist die Etablierung und der Einsatz einer Therapie mit hMSCs und deren extrazellulären Vesikeln nicht nur bei strahleninduzierten Wundheilungsstörungen eine vielversprechende Methode. So kann sie sich auch bei anderen schlecht heilenden Wunden, z. B. bei Polytraumapatienten mit Weichteildefekten oder nach Schuss- und Explosionsverletzungen als zielführende Option für die fächerübergreifende Behandlung verletzter Soldaten erweisen.
Literatur
- EL Andaloussi S. Mäger I, Breakefiled XO, Wood MJA: Extracellular vesicles: biology and emerging therapeutic opportunities. Nat Rev Drug Discov 2013; 12: 347–357. mehr lesen
- Bey E,Prat M, Duhamel P et al.: Emerging therapy for improving wound repair of severe radiation burns using local bone marrow-derived stem cell administrations. Wound Repair Regen 2010; 18(1): 50–58. mehr lesen
- Chapel A, Francois S, Douay L, Benderitter M, Voswinkel J: Fifteen years of preclinical and clinical experiences about biotherapy treatment of lesions induced by accidental irradiation and radiotherapy. World J Stem Cells 2013; 5(3): 68–72. mehr lesen
- Demaria M, Ohtani N, Youssef SA et al.: An essential role for senescent cells in optimal wound healing through secretion of PDGF-AA. Dev Cell 2014; 31(6): 722–733. mehr lesen
- Fekete N, Erle A, Amann EM et al.: Effect of high-dose irradiation on human bone-marrow-derived mesenchymal stromal cells. Tissue Eng Part C - Methods 2015; 21(2): 112—122. mehr lesen
- Fekete N, Rojewski MT, Fürst D et al.: GMP-compliant isolation and large-scale expansion of bone marrow-derived MSC. PLoS One 2012; 7(8): e43255. mehr lesen
- Gjerde C, Mustafa K, Hellem S et al.: Cell therapy induced regeneration of severely atrophied mandibular bone in a clinical trial. Stem Cell Res Ther 2018; 9: 213. mehr lesen
- Gómez-Barrena E, Rosset P, Gebhard F et al.: Feasibility and safety of treating non-unions in tibia, femur and humerus with autologous, expanded, bone marrow-derived mesenchymal stromal cells associated with biphasic calcium phosphate biomaterials in a multicentric, non-comparative trial. Biomaterials 2019; 196: 100–108. mehr lesen
- Kim N, Choi KU, Lee E et al.: Therapeutic effects of platelet derived growth factor overexpressed-mesenchymal stromal cells and sheets in canine skin wound healing model. Histol Histopathol 2020; 35: 751–767. mehr lesen
- Lataillade J, Doucet C, Bey E et al.: New approach to radiation burn treatment by dosimetry-guided surgery combined with autologous mesenchymal stem cell therapy. Regen Med 2007; 2(5): 785–794. mehr lesen
- Lener T, Gimona M, Aigner L et al.: Applying extracellular vesicles based therapeutics in clinical trials - an ISEV position paper. J Extracell Vesicles 2015; 4: 30087. mehr lesen
- Maxson S, Lopez ES, Yoo D et al.: Concise review: role of mesenchymal stem cells in wound repair. Stem Cells Transl Med 2012; 1(2): 142–149. mehr lesen
- Reyes EH, Baciu F, Benderitter M et al.: Medical Response to Radiological Accidents in Latin America and International Assistance. Radiat Res 2016; 185(4): 359–365. mehr lesen
- Rigotti G, Marchi A, Galiè M et al.: Clinical treatment of radiotherapy tissue damage by lipoaspirate transplant: A healing process mediated by adipose-derived adult stem cells. Plast Reconstr Surg 2007; 119(5): 1409–1422. mehr lesen
- Rojewski MT, Lotfi R, Gjerde C et al.: Translation of a standardized manufacturing protocol for mesenchymal stromal cells: A systematic comparison of validation and manufacturing data. Cytotherapy 2019; 21(4): 468–482. mehr lesen
- Shukla L, Yuan Y, Shayan R, Greening DW, Karnezis T: Fat Therapeutics: The Clinical Capacity of Adipose-Derived Stem Cells and Exosomes for Human Disease and Tissue Regeneration. Front Pharmacol 2020; 11: 158. mehr lesen
Für die Verfasser
Oberregierungsrätin Dr. Tanja Popp
Institut für Radiobiologie der Bundeswehr
Neuherbergstr. 11, 80937 München
E-Mail: tanjapopp@bundeswehr.org
1 Bei der dosisgesteuerten Chirurgie wird die vom Gewebe aufgenommene Dosis an verschiedenen Punkten rekonstruiert. Dann werden Gewebeanteile, die keine Chance auf langfristige Heilung aufweisen, entfernt. Die Dosisrekonstruktion der radioaktiven Strahlung erfolgt mittels Bildgebung und Monte Carlo-Simulation [10].