
SORGENFREI DEN DURST LÖSCHEn
Zur Trinkwasserversorgung des
Deutschen Einsatzkontingents in Mali, Afrika
Veterinärmedizinische Wasseruntersuchungen 2020 im Camp Castor
Natalie Gohrkea1
a Zentrales Institut des Sanitätsdienstes der Bundewehr Kiel
Zusammenfassung
Die Versorgung mit Trinkwasser ist für militärische Einsätze essenziell. Dabei ist es logistisch nicht möglich, den Trinkwasserbedarf durch Versorgung aus Deutschland zu decken. Im Einsatzland beschafftes oder aufbereitetes Trinkwasser muss im Hinblick auf einwandfreie chemische und bakteriologische Unbedenklichkeit überprüft werden, um eine Gesundheitsgefährdung der Truppe auszuschließen.
Am Beispiel des MINUSMA-Einsatzes in Mali wird ein Überblick über die in diesem Zusammenhang durchgeführten veterinärmedizinischen Untersuchungen, erhobenen Befunde und getroffenen Maßnahmen im Jahre 2020 berichtet.
Als Fazit ist dabei festzustellen, dass die Versorgung der eingesetzten Kräfte mit gesundheitlich unbedenklichem Trinkwasser zu jeder Zeit sichergestellt war, was nur durch den gemeinsamen Einsatz von Veterinärmedizinern und Pharmazeuten/Lebensmittelchemiker vor Ort gewährleistet werden konnte.
Schlüsselwörter: Veterinärmedizin, Veterinär, Trinkwasser, Mikrobiologie, Afrika, MINUSMA, Gesundheit
Keywords: veterinary medicine, veterinarian, potable water, microbiology, Africa, MINUSMA, health
Einleitung
Die Hauptkräfte des deutschen Einsatzkontingentes MINUSMA 2 (DEU EinsKtgt) sind im Camp Castor (CC) in Gao eingesetzt. Das deutsche EinsKtgt ist seit dem 01. Dezember 2017 hauptverantwortlicher Betreiber des CC und somit u. a. verantwortlich für die Sicherstellung der Versorgung mit einer in diesen Breitengraden besonders wertvollen bzw. existenziellen Ressource: Wasser! Der Zugang zu sauberem Trinkwasser ist unabdingbare Voraussetzung für die Durchführung eines Auslandseinsatzes oder das Betreiben eines Feldlagers.
Die Anforderungen an das Trinkwasser werden vor dem Hintergrund der Beteiligung und des Aufwuchses deutscher Kräfte an multinationalen Einsätzen in Westafrika abweichend von den deutschen Rechtsverordnungen gemäß NATO-Standards gestellt. Des Weiteren wird im CC auch regelmäßig Trink- und Flaschenwasser aus dem Camp Vie Allemande in Niamey und dem Camp Senou in Bamako untersucht. Ein Überblick über die im Jahr 2020 untersuchten Proben wird in Abbildung 6 aufgeführt.
Das zum täglichen Verzehr angekaufte, in einzelne Flaschen abgefüllte Wasser („bottled water“) wird regelmäßig mikrobiologisch untersucht, um zu prüfen, ob es ohne Gefährdung der Soldaten von diesen getrunken oder verwendet werden kann. Diese Untersuchungen werden im für Trinkwasser akkreditierten MSE 3 -Laborcontainer Veterinärmedizinische Labor (VetMed Lab) durchgeführt (Abbildung 1).

Abb. 1: Blick in den MSE Container VetMed Lab
Ein Sanitätsoffizier Veterinär (SanOffzVet) leitet das veterinärmedizinische Labor und hat dabei im Schwerpunkt folgende Aufgaben:
- Koordinieren aller labortechnischen Maßnahmen im Fachgebiet,
- Durchführen mikrobiologischer Wasseruntersuchungen (Trinkwasser, Trinkwasserversorgungsanlagen, Brunnen und andere Einrichtungen zum Herstellen und Verteilen von Wasser) sowie
- Beprobung und Untersuchung von Lebensmitteln und Oberflächen in Verpflegungs- und Betreuungseinrichtungen (Hygienestatuskontrollen).
Der SanOffzVet dokumentiert seine Tätigkeit durch Erstellen von jeweiligen Gutachten und Prüfberichten über die jeweiligen Ergebnisse der durchgeführten Untersuchungen. Zur Sicherstellung einer mikrobiologisch einwandfreien, stabilen und nachhaltigen Wasserversorgung werden in Gao regelmäßige Beprobungen durchgeführt.
Vor Ort hergestelltes Trinkwasser sowie Flaschenwasser sind in Gao insbesondere aufgrund der klimatischen Bedingungen ein besonders wichtiges Element für die Leistungs- und Durchhaltefähigkeit der Soldaten und damit von operativer Bedeutung. Das Klima vor Ort ist ein arides Saharaklima mit wenigen Regentagen, vorwiegend im Juli und August. Es kommt zu Temperaturspitzen bis zu 60 °C im Sommer und über 30 °C in den Wintermonaten. Aufgrund der vorherrschenden Wasserknappheit ist ein sparsamer Umgang mit dieser wertvollen Ressource unbedingt geboten.
Im Camp befinden sich im Durchschnitt ca. 1 300 Soldaten. Der tägliche Wasserverbrauch beträgt durchschnittlich ca. 120 m3. Ein gewerbliches Wasseraufbereitungsunternehmen ist mit der Wasseraufbereitung und -versorgung des Lagers beauftragt; hierzu schöpft es aus mehreren Brunnen Rohwasser zur Aufbereitung.
Im Folgenden werden die zur Wasserversorgung eingesetzten Techniken und Verfahren sowie die von veterinärmedizinischer Seite erhobenen Befunde beschrieben.
Trinkwasserversorgung im Camp Castor
Für die Einsatzliegenschaft stehen eine stationäre Wasseraufbereitungsanlage (WAA) sowie eine Abwasseraufbereitungsanlage eines gewerblichen Betreibers zur Verfügung. Die WAA bereitet aus den Brunnen mit einem Ertrag von ca.150 m3/Tag Rohwasser mittels Umkehrosmose zu Trinkwasser auf. Aufgrund der Aufbereitungsart kommt es zu einem der Aufbereitung geschuldeten Verlust an Wasser, weshalb die Fördermenge des Rohwassers nicht der Menge des aufbereiteten Trinkwassers entspricht. Die Abwasseraufbereitungsanlage bereitet anfallendes Abwasser zu Brauchwasser mit Trinkwasserqualität auf; hierzu werden Umkehrosmose, UV-Bestrahlung und Chlorung eingesetzt. Dieses Wasser wird für die Toilettenspülung und die Wäscherei genutzt.
Die vorherrschenden Temperaturen können Änderungen der mikrobiologischen und physikalisch-chemischen Parameter des Wassers nach sich ziehen. Aufgrund dessen werden das gewonnene Rohwasser und das aufbereitete gespeicherte Trink-/Brauchwasser dauerhaft auf 25 °C temperiert (Abbildung 2).

Abb. 2: Behälter mit gespeichertem Trinkwasser in der stationären Wasseraufbereitung; die Lagerung erfolgt bei 25 °C.
Mikrobiologische Verunreinigungen
Mikroorganismen im Trinkwasserleitungssystem können sowohl im Trinkwasser selbst, aber auch als Biofilmbildner im Leitungssystem enthalten sein. Die Wassertemperatur, biologische Faktoren wie das Vorhandensein von Nährstoffen oder die Abwesenheit für Trinkwasser zugelassener Desinfektionsmittel, z. B. in Form von Natriumhypochlorid, beeinflussen die Überlebensfähigkeit und das Wachstum von Bakterien entscheidend. Von hygienischer Relevanz im Trinkwasser sind hauptsächlich mesophile Bakterien, deren Temperaturoptimum zwischen 25 °C und 40 °C liegt. Im Folgenden wird auf die zur Trink- und Flaschenwasseruntersuchung relevanten Keime näher eingegangen.
Keimspektrum
Escherichia Coli und coliforme Bakterien
Vorkommen und Ausmaß fäkaler Verunreinigungen sind wichtige Faktoren bei der Einschätzung der Wasserqualität und des Risikos einer Infektion bzw. der Gefährdung für die menschliche Gesundheit. Eine Untersuchung auf Escherichia coli (E. coli), normalerweise im Darm von Warmblütern vorkommend, gibt einen Hinweis auf solch eine Verunreinigung. Die Untersuchung auf coliforme Bakterien kann hingegen schwieriger zu interpretieren sein, da einige coliforme Bakterien im Boden und im Oberflächenwasser leben und nicht ausschließlich im Darm. Daher können coliforme Bakterien auf Fehler in der Wasseraufbereitung, -speicherung und -verteilung hinweisen, wenngleich deren Präsenz nicht beweisend für eine fäkale Verunreinigung ist [16]. Coliforme Bakterien und E.coli gehören der Familie der Enterobacteriaceae an. Diese sind in der Lage, unter bestimmten Bedingungen Glucose fermentativ unter Säurebildung oder Säure- und Gasbildung abzubauen .Coliforme Bakterien sind gramnegative stäbchenförmige Bakterien, die ß-D-Galactosidase produzieren. E.coli hingegen sind in der Lage, ß-D-Galactosidase und ß-D-Glucuronidase zu exprimieren [14][S.375–378, 393]. Diese Fähigkeiten werden bei der Membranfiltration zur Differenzierung genutzt.
Enterokokken
Enterokokken vermehren sich nicht im Wasser und sind sehr widerstandsfähig gegenüber Umwelteinflüssen, zum Teil auch gegen Chlor. Im Wasser sind sie überlebensfähiger als E. coli und aufgrund dessen geeignete Indikatorkeime [14][S.381–383]. Sie gehören zur normalen Darmflora von Menschen und Tieren und können als Indikatoren für eine (auch länger zurückliegende) fäkale Verunreinigung betrachtet werden [11].
Clostridien
Sulfitreduzierende sporenbildende Anaerobier dienen vor allem dem Aufzeigen länger zurückliegender Verunreinigungen, da sie in der Umwelt sehr stabil sind. Als bekannter Vertreter dieser Gruppe ist Clostridium perfringens (C. perfringens) ein allgemein anerkannter Indikatorkeim, da dieser nahezu genauso widerstandsfähig sein soll wie Parasitendauerformen [15]. Dieses grampositive, strikt anaerobe Bakterium bildet im Darmtrakt von Tier und Mensch Sporen, die im Gegensatz zur vegetativen Form hitzeresistent sind. C. perfringens kommt im Darm sowohl in Form von Sporen als auch von vegetativen Zellen vor, Sporen sind außerdem in Umweltproben zu finden [14][S.383]. Die Sporen von C. perfringens überleben monatelang im Wasser und somit viel länger als andere Fäkalbakterien. Eine unmittelbare Gesundheitsgefährdung durch die Aufnahme von Clostridien über das Trinkwasser besteht nicht [14][S.383], jedoch ist es möglich, dass Lebensmittel über das Wasser kontaminiert werden und dass es durch die Zubereitung und bei anschließender ungeeigneter Lagerung zu Vermehrung dieser Keime mit in der Folge ernsthafter Erkrankungen kommen kann [1].
Pseudomonas aeruginosa
Pseudomonas aeruginosa (P.aeruginosa) ist ein ubiquitär vorkommendes Umweltbakterium, das sowohl im Boden als auch im Oberflächenwasser vorkommt und bei sehr niedrigen Nährstoffkonzentrationen wachsen kann [14][S.421;17]. P.aeruginosa ist in der Lage, sich bei niedrigen Temperaturen zu vermehren. Die Widerstandsfähigkeit und die Fähigkeit zur Biofilmbildung ist unter anderem auf die Produktion eines Alginats (Polymer aus Mannuron- und Galuronsäure) zurückzuführen, welches die Bakterien wie eine Schleimschicht umgibt [14][S.423]. Die genannten Eigenschaften ermöglichen es den Bakterien, in wasserführenden Systemen zu überleben. In Filtern von Wasseraufbereitungsanlagen findet eine stärkere Vermehrung von P. aeruginosa statt [14][S.423]. Gefahren des Einbringens von P.aeruginosa ins Trinkwassersystem bestehen bei kontaminierten Materialien im Rahmen von Bauarbeiten am Leitungsnetz oder bestehenden bzw. neu gebauten Trinkwasserinstallationen [17].
P.aeruginosa gilt als fakultativ pathogener Keim und kann bei entsprechend disponierten Patienten eine Pseudomonas-Infektion durch invasive Fremdkörpersysteme wie Harnwegskatheter, Beatmungstuben, aber auch durch Besiedlung von offenen akuten oder chronischen Wunden auslösen. Auch bei nicht immunsupprimierten Personen kann es zu Wundinfektionen, Ohr- oder Bindehautentzündungen kommen [17].
Die meisten Stämme von P.aeruginosa produzieren verschiedene lösliche Pigmente wie Pyocyanin (blaugrün), Pyoverdin (gelblich-fluoreszierend) und Pyorubin (rötlich). Wenige Ausnahmen bilden keine Pigmente [21][S.423].
Koloniezahl als Indikator
Mit der Bestimmung der Koloniezahl (untersucht mittels Anzucht bei 22°C und bei 36°C) können hygienisch relevante Veränderungen der Trinkwasserflora erfasst werden [3]. Der Wert von 100 koloniebildenden Einheiten (KbE) in 1 ml darf nach Trinkwasserverordnung (TrinkwV) nicht überschritten werden [3]. Eine erhöhte Koloniezahl kann ein Hinweis auf mikrobielles Wachstum im Leitungs- und Verteilungsnetz, auf nachträgliche Verkeimung in der Trinkwasserinstallation und/oder zusätzlich auf in der Trinkwasserinstallation integrierte technische Einrichtungen sein. Lange Stagnationszeiten im Leitungssystem können ebenfalls zu erhöhten Koloniezahlen führen [14][S.378–379].
Eine bestimmte Menge an Bakterienkolonien gehört zur gewöhnlichen Flora von natürlichem Mineralwasser und kann nach Abfüllung in Flaschen vorkommen [12]. Die Bestimmung der Koloniezahl sollte innerhalb von 12 Stunden nach Abfüllung erfolgen [2]. Diese Zeit kann aufgrund der Entfernung zum Lieferbetrieb nur selten eingehalten werden. Trotz der Zeitüberschreitung wird dieser Parameter im VetMedLab in Gao untersucht. Die übrigen genannten mikrobiologischen Parameter bleiben hiervon unberührt.
Mikrobiologische Untersuchung von Trinkwasser
Die Bereitstellung von mikrobiologisch sicherem Trinkwasser – vom Brunnen bis zum Wasserhahn – ist eine Hauptaufgabe der Trinkwasserversorgungsinfrastruktur. Die routinemäßige Trinkwasseruntersuchung ist daher – neben dem bestimmungsgemäßen Betrieb – eine der wichtigsten Maßnahmen zur Einhaltung der hygienischen Anforderungen, um stets die Qualität des Trinkwassers sicher zu stellen.
Nur minimale Anforderungen: STANAG 2136/AMedP-4.9
Die Beurteilungsgrundlage für die Untersuchung von Trinkwasser bei Regelbeprobung im Betrieb ist das Standardization Agreement (STANAG) 2136/AMedP-4.9 (Requirements for Water Potability during Field Operations and in Emergency Situations) [13]. Diese Beurteilungsgrundlage gibt allerdings nur einen sehr geringen Untersuchungsumfang vor. Danach sind die zu untersuchenden Parameter Enterokokken und coliforme Keime sowie E. coli vorgegeben, die 0 KbE in 100 ml nicht überschreiten dürfen; andere Erreger werden nicht bewertet.
Die Untersuchungsmethoden (z. B. Bebrütungstemperatur) sind im STANAG nicht vorgegeben. In Gao werden deshalb in Anlehnung an die deutsche Trinkwasserverordnung (TrinkwV) weitere Parameter in die mikrobiologischen Trinkwasseruntersuchungen integriert. Dabei werden sowohl qualitative als auch quantitative Untersuchungsverfahren angewendet. Folgernd werden die Untersuchungen aus mikrobiologischer Sicht auf Koloniezahl (angegeben in KbE pro ml) bei 22 °C und 36 °C Bebrütungstemperatur und P. aeruginosa ergänzt.
Die Verfahren für die quantitative Untersuchung auf spezifische Erreger wie coliforme Bakterien, Enterokokken und Pseudomonaden in Trinkwasser beruhen u. a. auf einer Membranfiltration von 100 ml Wasserprobe, anschließender Auflage des Filters auf ein entsprechendes Nährmedium und nachfolgender Kultivierung und Berechnung der Anzahl der Zielorganismen. Hierzu wird das zu prüfende Probevolumen steril mit Hilfe einer Apparatur durch einen feinporigen Membranfilter gesaugt, sodass mögliche enthaltene Bakterien in der Filtermembran festgehalten werden. Der Filter wird im Anschluss auf die jeweilige Selektivmedienplatte aufgelegt, die je nach enthaltenen Substraten das Wachstum bestimmter Keime begünstigt. Die Agarplatten werden auf dem Deckel liegend bebrütet, um eventuell heruntertropfendes Kondenswasser auf den Membranfilter zu verhindern. Die Probenmengen zur Membranfiltration von Flaschenwasser können der Tabelle 1 entnommen werden.
Quantitative Untersuchungsmethoden für Wasser
Koloniezahl (aerobe mesophile Gesamtkeimzahl)
Unter Koloniezahl versteht man die Anzahl von Kolonien, die unter festgelegten Bedingungen in einer bestimmten Zeit wachsen und bei sechs- bis achtfacher Lupenvergrößerung auszählbar sind [3].
Für das Verfahren zum quantitativen Nachweis der Koloniezahl in Wasser werden die im DEV-Nähragar mittels Plattengussverfahren angelegten, nach aerober Bebrütung gebildeten Kolonien ausgezählt. Angegeben werden die ausgezählten Kolonien in KbE/ml (Abbildung 3).
Dafür wird 1 ml Wasserprobe in einer Petrischale mit DEV-Agar vermischt und aerob 44 h ± 4 h bei 22 °C bzw. 36 °C bebrütet [3].
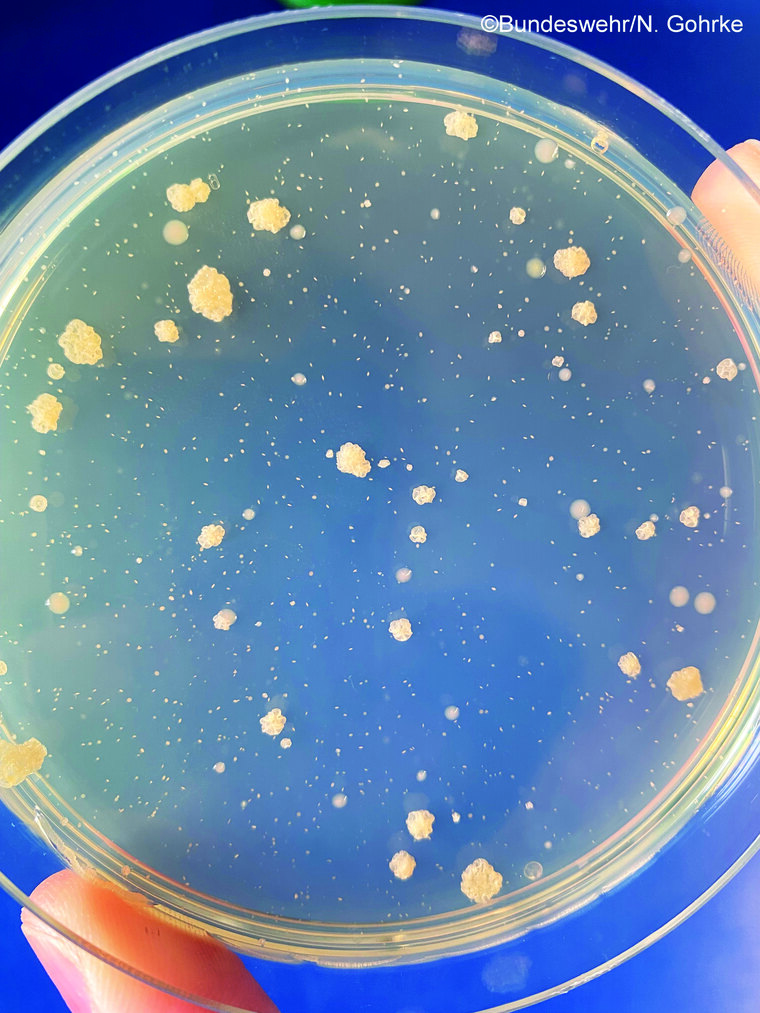
Abb. 3: Bestimmung der Koloniezahl im DEV-Gussagar
E.coli/Coliforme Keime
Der Membranfilter wird auf den chromogenen Coliformen Agar (CCA-Agar) aufgelegt und 21 h bis 24 h bei 36 °C aerob bebrütet. Die rosa bis roten β-D-Galactosidase-positiven Kolonien zählen als verdächtige coliforme Keime, die nicht E. coli sind, und werden durch eine negative Oxidase-Reaktion bestätigt. Die dunkelblauen bis violetten β-D-Galactosidase- und β-D-Glucuronidase-positiven Kolonien zählen als E. coli. Die Gesamtzahl an coliformen Bakterien beinhaltet die Summe der Oxidase-negativen rosa bis roten Kolonien und aller dunkelblauen bis violetten Kolonien (siehe Abbildung 4) [7].
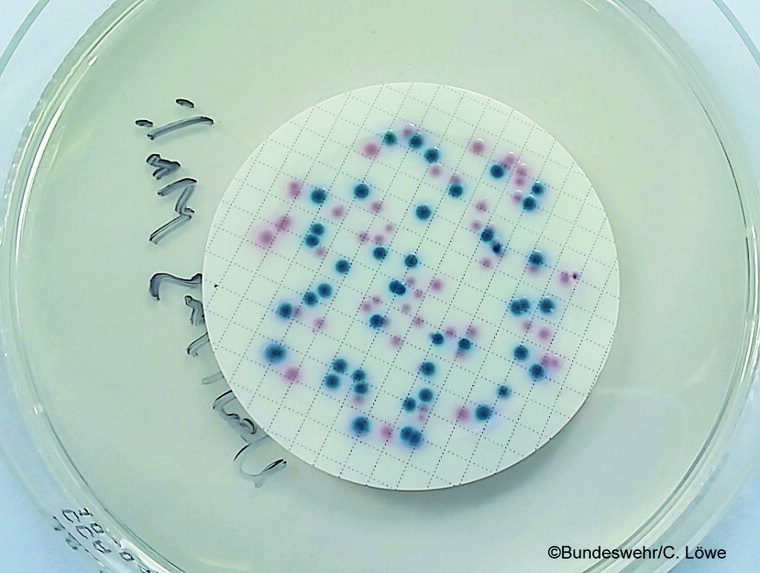
Abb. 4: Membranfilter auf CCA-Agar mit rosa bis roten und dunkelblau bis violetten Kolonien von E. coli bzw. coliformen Keimen
Enterokokken
Nach Auflegen des Membranfilters auf Tetrazolium-Azid-Agar nach Slanetz & Bartley (SlaBa) wird dieser bei 36 °C für 44 h ± 4 h aerob bebrütet. Das Wachstum der gesamten begleitenden gramnegativen mikrobiellen Flora wird durch Natriumazid im Agar gehemmt. Enterokokken reduzieren 2,3,5-Triphenyl-Tetrazoliumchlorid (TTC), um ein rotes Formazan in der Bakterienzelle zu ergeben. Ihre Kolonien sind daher rosa bzw. rot bis rotbraun gefärbt. Stickstoff, Mineralien und Aminosäuren werden durch den Zusatz von Tryptose bereitgestellt, während Hefeextrakt Vitamine liefert. Alle roten, braunen oder rosafarbenen Kolonien gelten als verdächtig und werden ausgezählt. Bei Wachstum verdächtiger Kolonien wird der Membranfilter auf vorgewärmten Galle-Äsculin-Azid-Agar überführt und weitere 2 h bebrütet. Geschwärzte Kolonien oder Kolonien über geschwärztem Agar werden ausgezählt (Abbildung 5) [6].
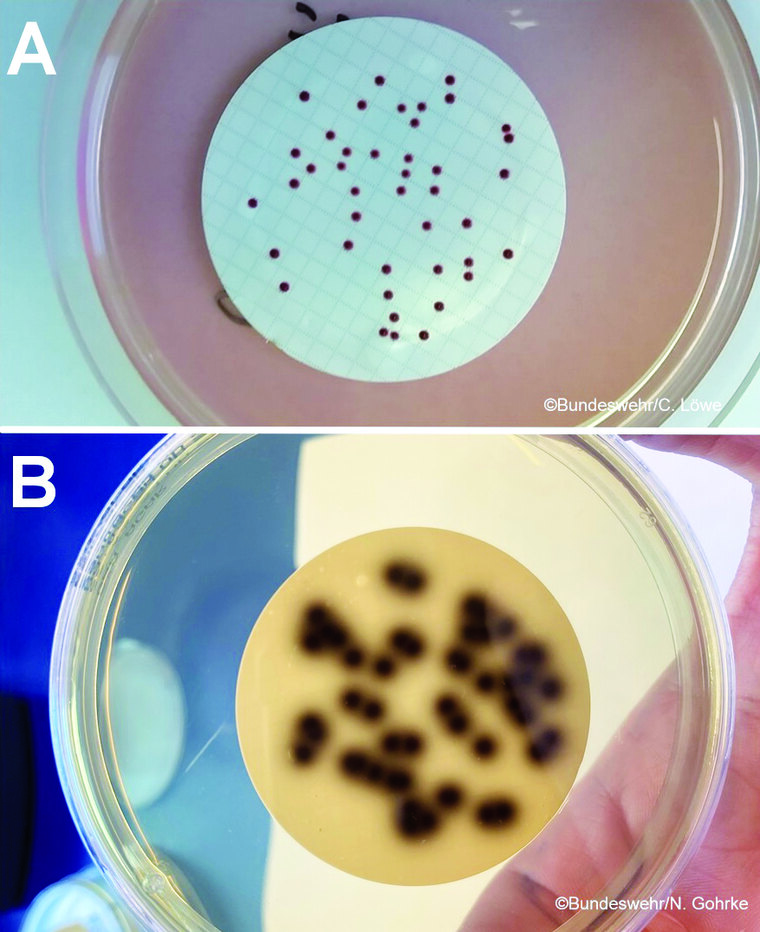
Abb. 5: Nachweis von Enterokokken in Form von kastanienbraunen Kolonien auf Tetrazolium-Azid-Agar (A) und Bestätigungsreaktion auf GÄA-Agar (B), auf dem es zur Bildung schwarzer Kolonien bzw. zu einer Schwärzung des Agars kommt.
Pseudomonas aeruginosa
Der Pseudomonas-CN-Agar (CN) mit dem aufgelegten Membranfilter wird ebenfalls bei 36 °C für 44 h ± 4 h aerob bebrütet [5]. Das im Nähragar enthaltene Cetrimid ist eine quaternäre Ammoniumverbindung mit bakterizider Aktivität und unterdrückt das Wachstum von kontaminierenden anderen Bakterien wie Klebsiella, Proteus oder Provindencia spp. fast vollständig [10]. Die Kolonien mit Pigmentbildung gelten als verdächtig. Zusätzlich wird eine Kontrolle auf Fluoreszenz unter UV-Licht durchgeführt. Verdächtige Kolonien werden ausgezählt und bestätigt. Diese Bestätigung erfolgt durch die Oxidasereaktion, dem Nachweis von Ammoniakbildung aus Acetamidlösung und dem Fluoreszenznachweis auf King B-Medium (Abbildung 6) [5].
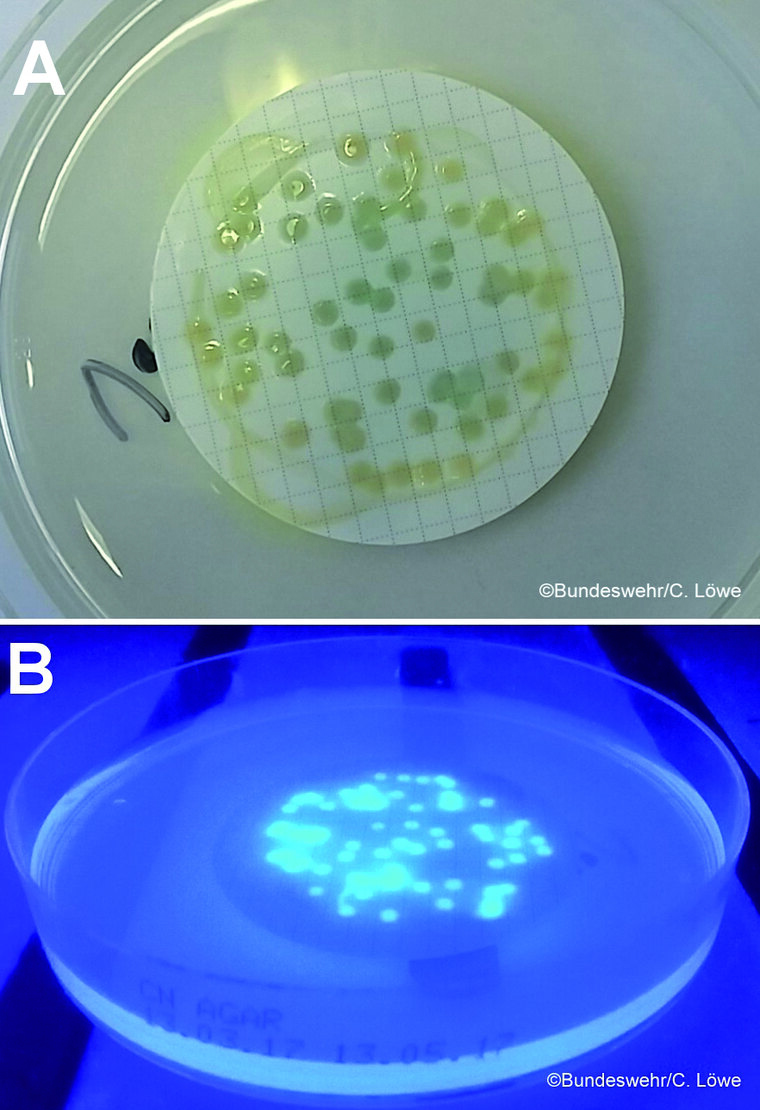
Abb. 6: Grünliche Kolonien auf Pseudomonas-CN-Agar (A) deuten auf Wachstum von P. aeruginosa hin; der Nachweis der Fluoreszenz (B) erhärtet den Verdacht auf eine Kontamination des Trinkwassers mit diesem Keim.
Qualitative Untersuchungsmethoden für Wasser
Zur qualitativen Bestimmung von Enterokokken, P. aeruginosa und E.coli / coliformen Keimen im Wasser können die Testverfahren Enterolert®, Pseudalert® und Colilert® verwendet werden. Es handelt sich hierbei um Anreicherungsmethoden (Flüssiganreicherung), bei denen ein definiertes Wasservolumen mit einer bestimmten Menge Nährmedium gemischt wird. Dieses Verfahren weist oben genannte Bakterien im Bereich von 1 KbE/100 ml Wasser bereits innerhalb von 24 h nach.
Das Prinzip funktioniert bei den drei Testverfahren ähnlich mittels bakterienspezifischen Nährstoffindikatoren. Im Folgenden wird der Nachweis von coliformen Bakterien und E. coli mit dem System Colilert® beispielhaft beschrieben. Dabei wird die Enzymaktivität der ß-Galactosidase und ß-Glucuronidase genutzt: Die Wasserprobe färbt sich gelb, wenn das im Nährstoffindikator enthaltene ONPG (o-Nitrophenyl-ß-D-galactopyranosid) von coliformen Bakterien metabolisiert wird (Abbildung 9, obere Reihe links). Der weitere Nährstoffindikator MUG (4-Methylumbelliferyl-ß-Glucironid) hingegen wird von E. coli umgesetzt und es kommt zu einer blauen Fluoreszenz (Abbildung 10) [14][S.377].

Abb. 7: Qualitativer Nachweis von E. coli und coliformen Keimen mit dem Testkit Colilert®:(roter Pfeil; die beiden anderen Becherstapel enthalten andere Tests): (A) In der unteren Reihe Negativkontrollen, in der oberen Reihe ist deutlich die Gelbfärbung bei positiver Probe erkennbar, bestätigt durch sichtbare Fluoreszenz (B) unter Schwarzlicht (zweite Probe von rechts, Pfeil).
Mikrobiologische Untersuchung von Flaschenwasser
Das zum täglichen Verzehr angekaufte Wasser („bottled water“) wird nach den Vorgaben des CODEX ALIMENTARIUS: Standard for Natural Mineral Waters (CXS108–1981) in Verbindung mit den in ANNEX I: Code of Hygienic Practice for Collecting, Processing and Marketing of Natural Mineral Waters (CACRCP-33–1985) definierten mikrobiologischen Kriterien untersucht [8][9].
Bei den zu untersuchenden Parametern handelt es sich um: E.coli, coliforme Keime, Enterokokken, sulfitreduzierende, sporenbildende Anaerobier, P. aeruginosa und die aerobe mesophile Keimzahl.
Die im Annex I des Code of Hygienic Practice for Collecting, Processing and Marketing of Natural Mineral Waters (CAC/RCP 33–1985) genannten Untersuchungsumfänge und -methoden sind in Tabelle 1 dargestellt.
Tab. 1: Mikrobiologische Kriterien, anzuwenden bei: Ursprungsquelle, im Verlauf der Produktion und im Endprodukt (nach [9])
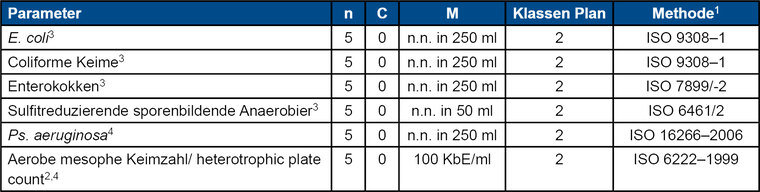
1 Es können andere Methoden mit gleichwertiger Sensitivität und Reproduzierbarkeit verwendet werden, wenn sie entsprechend validiert wurden (z. B. beruhend auf ISO/TR/13843).
2 Entnahmestelle: nur an der Quelle, während der Produktion und innerhalb von 12 Stunden nach Abfüllung
3 Fäkalindikator
4 Indikator für das Prozessmanagement
n = Anzahl der Proben, die den Kriterien entsprechen müssen
C = maximal zulässige Anzahl von fehlerhaften Probeneinheiten in einem 2-Klassen-Plan
M = mikrobiologischer Grenzwert, der in einem 2-Klassen-Plan gute Qualität von mangelhafter Qualität trennt.
n.n.= nicht nachweisbar
Auf Grundlage der ISO Normen werden die Methoden der entsprechenden DIN EN ISO Normen bzw. die Methoden der TrinkwV verwendet. Die Untersuchungen erfolgen für E.coli, coliforme Keime, Enterokokken und P. aeruginosa durch Membranfiltration von 250 ml Flaschenwasser und werden analog zu den beschriebenen Methoden von Trinkwasser durchgeführt (siehe oben).
Sulfitreduzierende, sporenbildende Anaerobier
Für die sulfitreduzierenden, sporenbildenenden Anaerobier werden 50 ml Flaschenwasser membranfiltriert und wie folgt untersucht:
Eine hochwertige Nährgrundlage (TSC-Agar) gibt Clostridien beste Entwicklungsmöglichkeiten. Sulfit und Eisensalz bewirken eine Markierung der schwefelwasserstoffbildenden Kolonien durch eine Schwarzfärbung; das im Agar enthaltende Cycloserin hemmt die Begleitflora [4]. Der Zeitraum zwischen dem Auflegen des Membranfilters auf den TSC-Agar und dem Beginn der Bebrütung sollte möglichst kurz sein und eine Stunde nicht überschreiten. Der TSC-Agar wird in einem sogenannten Anaerobiertopf überführt, hierbei wird ein anaerobes Klima erzeugt und für 21 h ± 3 h bei 44 °C anaerob bebrütet [4]. Verdächtige schwarze, graue oder gelb-braune Kolonien, selbst wenn die Färbung schwach ausgebildet ist, müssen in der Bestätigungsprüfung kontrolliert werden.
Zur Bestätigung werden die verdächtigen Kolonien auf Blutagarplatten subkultiviert und anaerob bebrütet. Anaerob gewachsene Kolonien werden auf Filterpapier ausgestrichen und mit 2 bis 3 Tropfen saurem Phosphatase-Reagenz beträufelt. Eine purpurne Färbung innerhalb von 3 bis 4 min wird als positive Reaktion gewertet. Eine alternative Bestätigungsreaktion ist die Subkultivierung verdächtiger Kolonien auf m-CP-Agar mit anaerober Bebrütung für 21 h ± 3h bei 36 °C und anschließender Bedampfung mit Ammoniumhydroxid über die Dauer von 20–30 s [4]. Eine Rosa- bis Rotfärbung zunächst dunkelgelber Kolonien gilt als bestätigter Nachweis der sauren Phosphatase.
Ergebnisse und Beurteilung
Ob zur Erhaltung des Flüssigkeitshaushaltes in Form von aufbereitetem Trinkwasser oder Flaschenwasser, als Bestandteil von Lebensmitteln zur Verwendung in Küchen und Versorgungseinrichtungen, zur täglichen Körperhygiene oder zur Reinigung von persönlichen Bedarfsgegenständen – die Versorgung mit Wasser ist eine essenzielle Grundvoraussetzung zur Gesunderhaltung des Menschen und somit auch elementare Basis für die Einsatzfähigkeit der Truppe.
Im Inland ist eine kontinuierliche Überprüfung der Wasserqualität in Liegenschaftsnetzen unabdingbar, wobei die Qualität der Wasserversorgungseinrichtungen in aller Regel gut ist. In Einsatzszenarien hat eine hochfrequente Kontrolle der Wasserqualität eine ganz besondere Bedeutung, da die Ergebnisse mikrobiologischer Untersuchungen lediglich etwas über den Zustand des Wassers zum Zeitpunkt der Entnahme aussagen. Die Wasserqualität am Ort der Gewinnung und Aufbereitung (siehe auch Abbildung 9) sowie die Verteilung müssen aufgrund zahlreicher Faktoren, wie wechselnde Brunnen, Verweilzeiten des Wassers während der Aufbereitung in Reservoiren und im Verteilernetz sowie unterschiedlicher Strömungsverhältnisse in einem sich vergrößernden und verändernden Leitungssystem, engmaschig untersucht werden. Bei einer nicht festen Infrastruktur in Einsatzlagern – wie auch in den Camps – sieht sich die einwandfreie Versorgung mit Trink-, Brauch- und Flaschenwasser weiteren Herausforderungen gegenübergestellt, da Versorgungs- und Aufbereitungsanlagen zunächst errichtet und anschließend permanent instandgehalten und überprüft werden müssen.
Ein Mangel an der Ressource Wasser oder eine mangelhafte Wasserqualität ist nicht nur einsatzentscheidend, sondern für jeden einzelnen Kontingentangehörigen überlebenswichtig und kann unter keinen Umständen hingenommen werden.
Entnahmestellen, Probenorte und Probenhäufigeit 2020
In Abbildung 8 sind die Entnahmestellen sowie die Probenahmeorte und –zahlen der Camps des Kalenderjahres 2020 (B) und der Anteil der beanstandeten und nicht beanstandeten Proben (A) gegenübergestellt. Der Vollständigkeit halber muss erwähnt werden, dass die Proben nach STANAG 2136/AMedP-4.9 mit den zu untersuchenden Parameter Enterokokken, E.coli und coliforme Bakterien nicht zu beanstanden waren. Hier wurden in Anlehnung an die TrinkwV die Parameter Koloniezahl bei 22 °C/36 °C und P. aeruginosa ergänzend untersucht. Bei den im Camp Castor detektierten beanstandeten Proben handelt es sich um eine Überschreitung der Grenzwerte bei Koloniezahl und P. aeruginosa in Zisternen und Flats, die aufgrund des geschlossenen Systems und der teilweise fehlenden Umwälzfunktion hochfrequenter untersucht wurden.
Die Trinkwasseruntersuchung im Camp Vie Allemande in Niamey und Camp Senou in Bamako wurden im Jahr 2020, sofern es die Sicherheits- und Corona-Lage zuließ, d. h. nicht durchgehend beprobt (Abbildung 8A). Auch der Abfall der Probezahlen am Ende des Jahres im Camp Castor beschreibt die auf das Minimum beschränkten Probenahmen. Im Camp Castor erfolgten aufgrund der Größe des Camps sichtbar mehr Probenahmen an unterschiedlichen Probenahmeorten (Abbildung 8B).
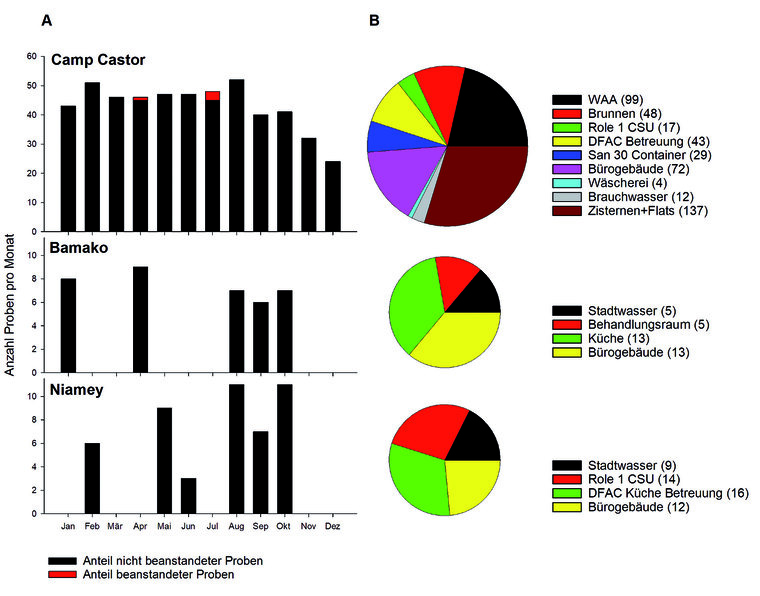
Abb. 8: Anzahl der Trinkwasserproben im Jahre 2020 in den untersuchten Camps (A); in der rechten Hälfte die Aufteilung nach den verschiedenen Entnahmeorten dargestellt (B)
Untersuchung von Rohwasser
Um u. a. die Art der Wasseraufbereitung in Abhängigkeit von der vorgefundenen Belastung zu wählen und damit den Wartungsaufwand für die WAA so gering wie möglich zu halten, wird das Rohwasser regelmäßig mikrobiologisch untersucht. Im Rohwasser der Brunnen wurden dafür ausschließlich erhöhte Keimzahlen und P. aeruginosa nachgewiesen (Abbildung 9).
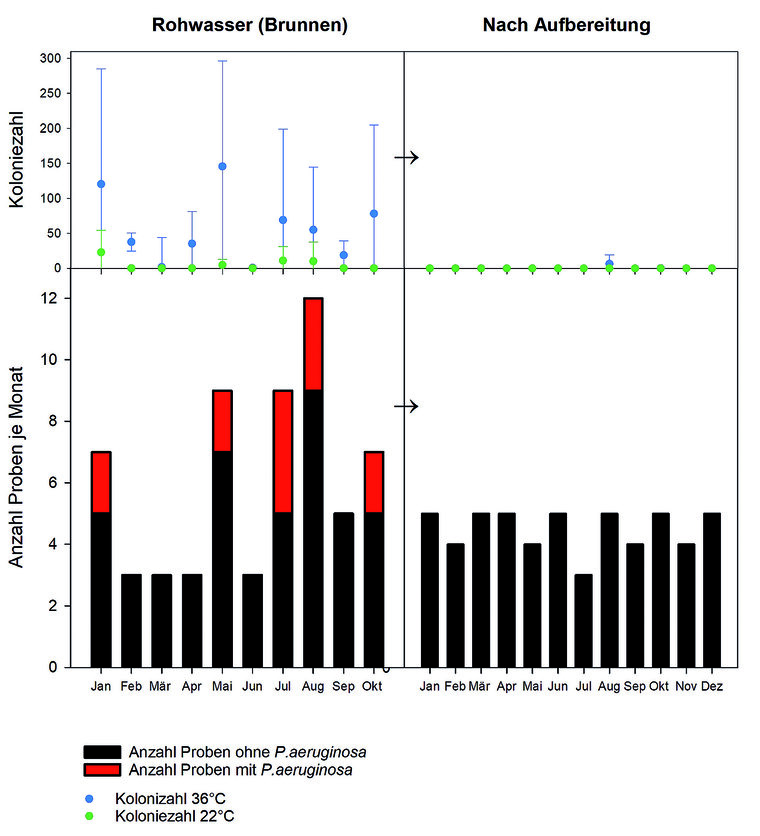
Abb. 9: Mikrobiologische Ergebnisse von Rohwasser vor und nach der Aufbereitung
In diesem Zusammenhang sei auch darauf hingewiesen, dass nach STANAG 2136/AMedP-4.9 keine Probe beanstandet werden musste. Wie bereits dargestellt wurden weitere Parameter in Anlehnung an die TrinkwV erhoben. Bei den Rohwasserproben wurde zusätzlich noch auf sulfitreduzierende sporenbildende Anaerobier untersucht, diese wurden aber nicht nachgewiesen. Die Funktionsfähigkeit der WAA ist nach Auswertung der mikrobiologischen Untersuchungen gegeben (Abbildung 9).
Untersuchung von Flaschenwasser
In dem bis Mitte 2020 zur Verfügung gestellten Flaschenwasser 1 wurde wiederholt P. aeruginosa nachgewiesen (Abbildung 10), was die Beanstandung des Wassers in einer signifikanten Anzahl von Fällen zur Folge hatte. Aufgrund dieser ersten bedenklichen Ergebnisse im Februar, nach dem bereits ein Drittel des Flaschenwassers aufgrund des Vorhandenseins von P. aeruginosa beanstandet werden musste, wurden nachfolgend die Probenahmefrequenz sowie die Anzahl der untersuchten Proben erhöht: Im März wurden im Rahmen von 4 Probenahmen 31 Proben durchgeführt, Spitzenreiter war der Monat Juli mit 52 untersuchten Proben aus 10 Probenahmen. In diesem Monat wurde P.aeruginosa in mehr als der Hälfte der Proben (ca. 56%) detektiert und das gelieferte Wasser somit beanstandet. Die höchste Rate an Beanstandungen erfolgte im Vormonat Juni mit rund 71% (n=7). Diese Proben entsprechen aus mikrobiologischer Sicht nicht den Anforderungen des CODEX ALIMENTARIUS in Verbindung mit den in der aufgeführten Tabelle im ANNEX I vorgegebenen Werten (siehe Tabelle 1) [8][9]. Eine Beurteilung der Gesamtkeimzahl erfolgte nicht, da die Proben nicht innerhalb von 12 h nach Abfüllung untersucht werden konnten.
In der Konsequenz wurde ab September auf ein anderes Flaschenwasser (Flaschenwasser 2) umgestellt, welches sowohl in stichprobenartigen Voruntersuchungen (Daten nicht abgebildet) als auch ab dem Zeitpunkt der Umstellung kontinuierlich einwandfreie mikrobiologische Ergebnisse erzielte (vergleiche Abbildung 10).
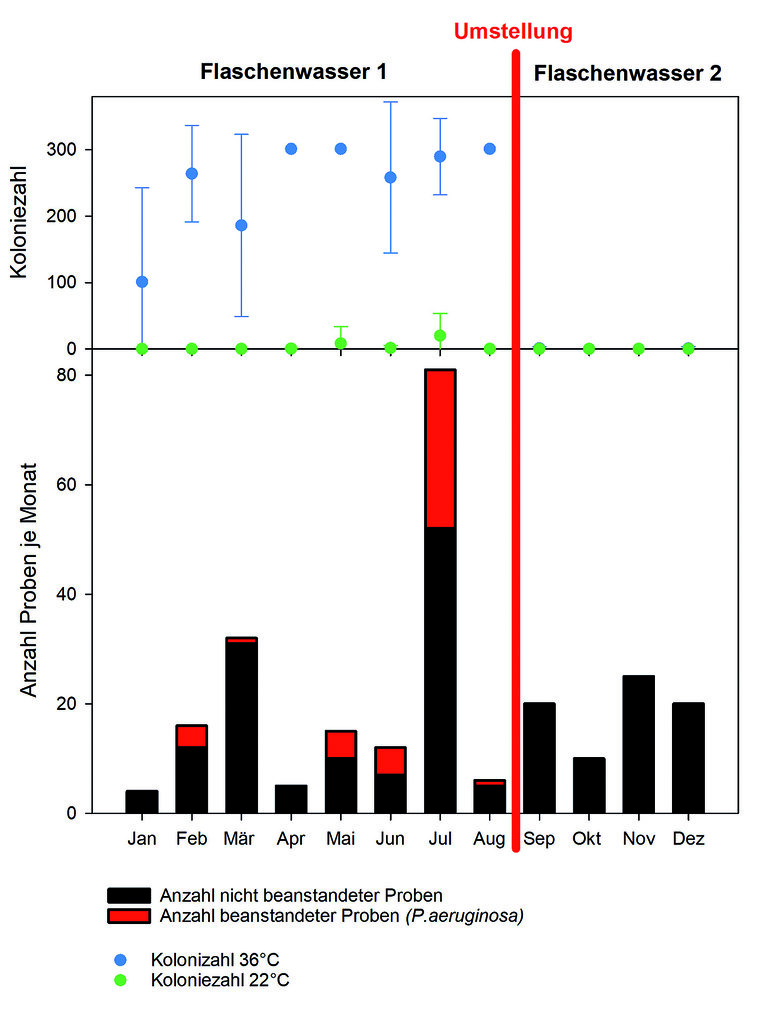
Abb. 10: Im Jahr 2020 untersuchtes Flaschenwasser im Überblick: Zur Berechnung der Mittelwerte der Koloniezahlen als Grundlage für die grafische Darstellung wurden alle Proben mit einer Koloniezahl > 300 auf 301 gesetzt.
Fazit
Diese im Jahre 2020 bei MINUSMA erhobenen Daten zeigen eindrucksvoll, dass nicht nur die eigens aufbereiteten Wasserbestände kontinuierlich überprüft werden müssen, sondern auch von industriell produziertem Mineralwasser aus Flaschen eine Gesundheits- und somit Einsatzgefährdung ausgehen kann, weshalb auch dieses im veterinärmedizinischen Labor kontinuierlich mikrobiell analysiert werden sollte.
Die Untersuchung der lebensnotwendigen Ressource Trinkwasser in Bezug auf seine mikrobiologisch einwandfreie Beschaffenheit ist eine wesentliche Aufgabe der Veterinärmedizin in der Bundeswehr. Gemeinsam mit der chemischen Trinkwasseruntersuchung, die durch SanStOffz Apotheker (Lebensmittelchemiker) erfolgt, wird die Bereitstellung hochwertigen und gesundheitlich in jeder Hinsicht unbedenklichen Trinkwassers gewährleistet.
Die Wasseruntersuchung erfolgt im Einsatz in akkreditierten MSE-Labor-Containern. Die Vorgaben für die angewendeten Verfahren und den Betrieb des veterinärmedizinischen Einsatzlabors sowie das Qualitätsmanagementsystem wurden durch das ZInstSanBw Kiel als Leitlabor festgelegt. Die vorgestellte Verfahrensweise ist jetzt seit mehreren Jahren einsatzerprobt. Sie wurde und wird kontinuierlich weiterentwickelt, um auch bei zukünftigen Einsätzen unseren Soldatinnen und Soldaten beim Griff zur Wasserflasche eines ganz sicher zu garantieren, dass sie sorgenfrei ihren Durst löschen können.
Literatur
- Augenthaler A, Huggenberger P (Edts.): Pathogene Mikroorganismen im Grund- und Trinkwasser. Basel: Birkhäuser Verlag 2003: 9. mehr lesen
- Bundesministerium der Justiz und für Verbraucherschutz: Verordnung über natürliches Mineralwasser, Quellwasser und Tafelwasser (Mineral- und Tafelwasser-Verordnung) vom 1. August 1984 (BGBl. I S. 1036), die zuletzt durch Artikel 25 der Verordnung vom 5. Juli 2017 (BGBl. I S. 2272) geändert worden ist). , letzter Aufruf 10. Dezember 2021. mehr lesen
- Bundesministerium für Gesundheit: Trinkwasserverordnung in der Fassung der Bekanntmachung vom 10. März 2016 (BGBl. I S. 459), zuletzt geändert durch Artikel 1 der Verordnung vom 22. September 2021 (BGBl. I S. 4343). , letzter Aufruf 10. Dezember 2021. mehr lesen
- Deutsches Institut für Normung: DIN EN ISO 14189:2016-11 „Wasserbeschaffenheit – Zählung von Clostridium perfringens – Verfahren mittels Membranfiltration“. Berlin: Beuth 2016
- Deutsches Institut für Normung: DIN EN ISO 16266: 2008-05 „Wasserbeschaffenheit- Nachweis und Zählung von Pseudomonas aeruginosa – Membranfiltrationsverfahren“. Berlin: Beuth 2008.
- Deutsches Institut für Normung: DIN EN ISO 7899-2 2000-11: Wasserbeschaffenheit - Nachweis und Zählung von intestinalen Enterokokken -Teil 2: Verfahren durch Membranfiltration. Berlin: Beuth 2000.
- Deutsches Institut für Normung: DIN EN ISO 9308-1:2017-09 „Wasserbeschaffenheit-Zählung von Escherichia coli und coliformen Bakterien – Teil 1: Membranfiltrationsverfahren für Wässer mit niedriger Begleitflora“. Berlin: Beuth 2017.
- FAO: Code of Hygienic Practice for Collecting, Processing and Marketing of Natural Mineral Waters CAC/RCP 33-1985, revised 2011. , letzter Aufruf 10. Oktober 2021. mehr lesen
- FAO: Codex Alimentarius - Standard for Natural Mineral Waters CXS 108-1981 von 1981, geändert 2019. , letzter Aufruf 10. Oktober 2021. mehr lesen
- Fisher Scientific: Thermo Scientific™ Pseudomonas C-N Selektiv-Agar (Cetrimid-Agar). , letzter Aufruf 10. Oktober 2021. mehr lesen
- Landesamt für Verbraucherschutz Sachsen-Anhalt: Enterokokken. , letzter Aufruf 10. Oktober 2021. mehr lesen
- Leclerc H, Moreau A: Mircobiological safety of natural mineral water. FEMS Microbiol Rev 2002; 26(2): 207-222. mehr lesen
- NATO: STANAG 2136/AMedP-4.9 (Requirements for Water Potability during Field Operations and in Emergency Situations). NATO 2013. , letzter Aufruf 8. Oktober 2021. mehr lesen
- Niesner N (Hrsg.): Höll Wasser, 10. Auflage. Berlin: DeGruyter 2020.
- Umweltbundesamt: Empfehlung zur Vermeidung von Kontaminationen des Trinkwassers mit Parasiten. Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz 2001; 44: 406-408. mehr lesen
- Umweltbundesamt: Coliforme Bakterien im Trinkwasser. Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz 2009; 52: 474-482. mehr lesen
- Umweltbundesamt: Empfehlung zur erforderlichen Untersuchung auf Pseudomonas aeruginosa, zur Risikoeinschätzung und zu Maßnahmen beim Nachweis im Trinkwasser vom 13.Juni 2017. , letzter Aufruf 10. Dezember 2021. mehr lesen
Manuskriptdaten
Zitierweise
Gohrke N: Zur Trinkwasserversorgung des Deutschen Einsatzkontingents in Mali, Afrika
Veterinärmedizinische Wasseruntersuchungen 2020 im Camp Castor. WMM 2021; 65(12): 449-458.
Verfasserin
Oberstabsveterinär Natalie Gohrke
Zentrales Institut des Sanitätsdienstes der Bundeswehr Kiel
Abteilung A
Kopperpahler Allee 120, 24119 Kronshagen
E-Mail: nataliegohrke@bundeswehr.org
1 Die Autorin war vom 12.November 2020 bis zum 29. Januar2021 als Sanitätsstabsoffizier Veterinär beim deutschen Einsatzkontingent MINUSMA im Camp Castor, Gao (Mali) eingesetzt.
2 MINUSMA steht für “United Nations Multidimensional Integrated Stabilization Mission in Mali”; die Truppe mit rund 13 000 Blauhelmsoldaten wurde 2013 vom UN-Sicherheitsrat eingesetzt, um ein Abrutschen des westafrikanischen Landes in Chaos zu verhindern. Die Bundeswehr ist mit ca. 1 100 Soldatinnen und Soldaten beteiligt.
3 MSE = Modulare Sanitätseinrichtung