Histologische Analyse von Doppelstrangbrüchen
in protonenbestrahlten 3D-Hautmodellen (Vortragsabstract)
Stephanie-Quinta Wagnera, Judith Reindlb, Jan Grundhöferb, Jessica Müllera, Matthias Sammerb, Sarah Schoofa, Steffen Müllera, Sarah Rudigkeitb, Nicole Matejkab, Matthias Porta, Harry Scherthana
a Institut für Radiobiologie der Bundeswehr in Verb. mit der Univ. Ulm, München
b Universität der Bundeswehr München, Institut für Angewandte Physik und Messtechnik, Neubiberg
Einleitung
In der Strahlentherapie können hohe Dosen ionisierender Strahlung in der Tumortherapie zu unerwünschten Nebenwirkungen im Normalgewebe führen, wobei die Haut häufig das limitierende Organ ist. Neuere Konzepte legen nahe, dass diese Dosisgrenzen z. B. durch eine Protonen-Minibeam-Radiotherapie (PMBRT, fokussierte Bestrahlung) umgangen werden können. Es handelt sich hierbei um Strahlkanäle mit einer Breite im Submillimeterbereich, die durch ihre geometrische Anordnung oberflächennahes Gewebe zwischen den Strahlkanälen aussparen und schonen (Abbildung 1) [2][5]. Durch eine Aufweitung und Streuung der Protonenstrahlen in der Tiefe kommt es durch Vorwärtsstreuung und den Aufbaueffekt zu einer homogenen Dosisverteilung im Tumor, ähnlich der einer konventionellen Strahlentherapie [6]. Jüngst konnte eine gewebeschonende Wirkung durch Protonen-Minibeam-Bestrahlung im Maus-Ohr-Modell demonstriert werden [2], jedoch gelang es bisher nicht, den schonenden Effekt der PMBRT anhand der sub-zellulären Verteilung von DNA-Schäden ortsgenau im 3D-Gewebe-Kontext nachzuweisen. In dieser Arbeit wurde erstmals eine Methode für die ortsgenaue 3D-Darstellung von DNA-Doppelstrangbruch-Schäden nach PMBRT in einem humanen Epidermismodell etabliert.
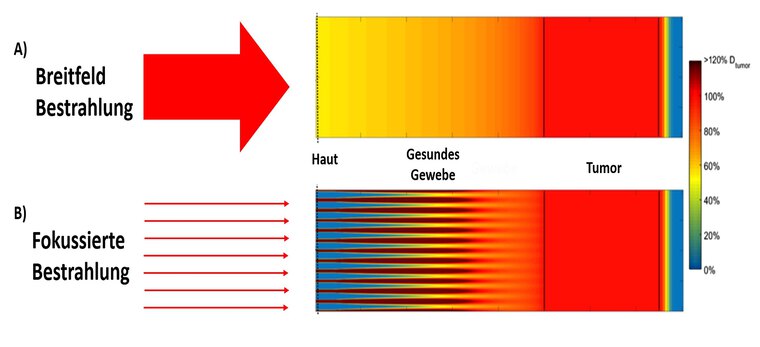
Abb. 1: Prinzip der Minibeam-Therapie: Dosisverteilung für homogene und Protonen-Minibeam-Bestrahlung
Der Tumor wird mit einer Tumordosis DTumor (= 100% auf der Farbcodierung) Breitfeld- (A) oder mit fokussierter (B) Protonenbestrahlung aus einer Richtung bestrahlt (Bestrahlung kommt von links). Die Dosis in den oberflächennahen Kanälen ist viel höher als die Tumordosis, jedoch wirkt keine Dosis in den blauen Arealen zwischen den Beams (reproduziert aus [4]).
Methoden
Am Rasterionenmikroskop SNAKE am Tandembeschleuniger des Mayer-Leibnitz-Laboratoriums (MLL) in Garching [3] wurden rekonstruierte humane Epidermis-Hautmodelle (epiCS, Fa. Cell Systems) mit einer mittleren Dosis von 2 Gy gegenüber Protonenstrahlen exponiert, wobei unterschiedliche Strahlenbreiten (s) von 66 µm (stark fokussiert) und 920 µm (Breitfeld) mit Abständen von 2,5 mm appliziert wurden. Anhand von Immunfärbung (IF) für die DNA-Doppelstrangbruch (DSB) Marker γH2AX und 53BP1 wurden DSB-DNA-Schäden und ihre Reparatur in der Epidermis dargestellt. Ferner wurde der Zelltod mittels IF für aktive Caspase-3 bis zu 72 h nach der Bestrahlung untersucht [1]. Mit Hilfe von automatisierter Fluoreszenzmikroskopie und Bildanalyse-Algorithmen (Strata-Quest, TissueGnostics) wurde jeder Zellkern im Hautmodellquerschnitt ortsannotiert, analysiert und die Ergebnisse pro Zelle entlang einer linearen Skala dargestellt. Dies ermöglichte eine ortsauflösende Darstellung und Positionsverfolgung der Zellkerne im Epidermisschnitt (Abbildung 2).
Ergebnisse
Ortsannotierte Analyse der DNA-Schäden
In nicht-bestrahlten Epidermismodellen konnten wir in ~20% aller Zellen γH2AX- und 53BP1-positive DSB-DNA-Schadensfoci beobachten (Abbildung 3A), wobei die positiven Zellen im Schnitt 1–3 Foci pro Zellkern aufwiesen (Abbildung 2A). Die Prozentzahl der Zellen mit fokalen DSB-Schäden nahm 30 min nach der Breitfeldbestrahlung stark zu (Abbildung 3A). Dieser Effekt fiel jedoch bei einer hoch fokussierten Minibeam-Bestrahlung mit der gleichen mittleren Dosis von 2 Gy wesentlich geringer aus (Abbildung 3A).
Eine genaue ortsannotierte Analyse der DNA-Schäden in individuellen Zellen entlang der Epidermisquerschnitte ergab folgende Schadensverteilung:
- In den nicht-bestrahlten Modellen waren Zellen mit fokalen DNA-Schäden locker über die Epidermisquerschnitte verstreut. In nur wenigen Zellkernen zeigte sich ein pan-nukleäres γH2AX-Signal, das eine massive DNA-Schädigung anzeigt (Abbildung 2A).
- Nach der Breitfeld-Bestrahlung waren in allen Zellen signifikant mehr 53BP1- und γ-H2AX-positive DSB-Foci gegenüber den nicht-bestrahlten Hautmodellen vorhanden, aber nur wenige Zellen mit pan-γH2AX-Signal zu sehen (Abbildung 2B).
- Die Protonenbestrahlung mit planar fokussierten Kanälen induzierte in den im Strahl liegenden Zellen ein pan-γ-H2AX-Schadensmuster, das eine starke Schädigung der DNA im Zellkern anzeigt. An den Rändern der Strahlkanäle war eine erhöhte Häufigkeit an Zellkernen mit DSB-Foci zu erkennen, was mit der stark abfallenden Dosis korrelierte. Zellen zwischen den Strahlkanälen zeigten dagegen kaum Schäden, was eine Schonung des nicht-bestrahlten Zwischengewebes indiziert (Abbildung 2C).
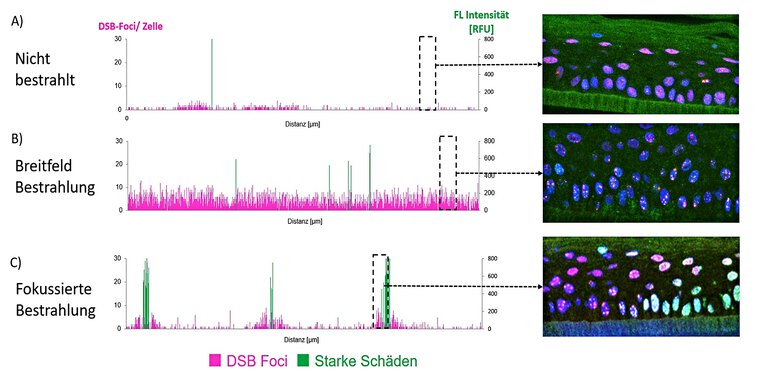
Abb. 2: Quantitative ortsauflösende Darstellung der DNA-Schäden entlang unterschiedlich bestrahlter Epidermismodell-Querschnitte: (A) Nicht-bestrahlte Kontrolle, (B) 920µm-Breitfeldbestrahlung, (C) fokussierte 66µm PMBRT Bestrahlung. Jeder pinkfarbene Balken in den Diagrammen steht für die Anzahl an DSB-Foci in jedem Zellkern entlang des Modells. Die grünen Balken zeigen die Position von Zellen an, die sehr starke DNA-Schäden (pan-nukleäres γH2AX –Signal) aufweisen, identifiziert durch eine hohe relative Fluoreszenz Intensitäten [RFU]. Die Fluoreszenz-Bilder rechts der Diagramme zeigen den jeweiligen markierten Ausschnitt der Grafik (Zellkerne: blau, γH2AX: grün, 53BP1: rot).
DNA-Reparatur und Zelltod
Über alle Zellen eines Hautmodells gemittelt wiesen die unbestrahlten Epidermiszellen 0,25 DSB-Foci/Zelle auf (bei 6 h waren es 0,5 Foci) (Abbildung 3B). Eine Breitfeld-Bestrahlung induzierte 30 min nach Bestrahlung in 65% aller Zellen DSB-Foci (Abbildung 3A) mit einem Mittel von 0,6 Foci/Zelle (Abbildung 3B). Dieser Wert fiel dann durch DNA-Reparatur über 72 h auf den Hintergrundwert ab (Abbildung 3B). 30 min nach fokussierter Minibeam-Bestrahlung stieg der durchschnittliche Wert im gesamten Epidermisquerschnitt auf DSB-Foci/Zelle an (Abbildung 3B), wobei nur 40% aller Zellen im Modell geschädigt waren (Abbildung 3A). Auch hier fiel der durchschnittliche DSB-Focus-Wert nach 72 h DNA-Reparatur auf den Kontrollwert ab (Abbildung 3B).
Die Frequenz stark geschädigter Zellen mit pan-nukleärem γH2AX-Signal nahm bis zu 24 h nach Bestrahlung ab, um 72 h nach Breitfeldbestrahlung wieder stark zuzunehmen (Abbildung 3C). Da eine pan-nukleäre γ-H2AX-Färbung auch durch Apoptose-induzierte DNA-Fragmentierung hervorgerufen werden kann, untersuchten wir den Zelltod mit aktivierter Caspase-3 IF. In allen Epidermismodellen waren bis 6 h nach der Bestrahlung nur selten apoptotische Zellen zu beobachten, deren Frequenz aber 24 h und 72 h nach Bestrahlung deutlich anstieg (Abbildung 3D).
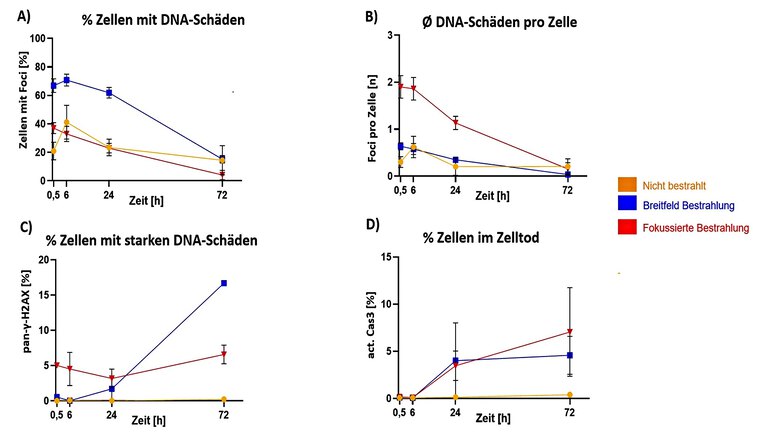
Abb.3: Vergleich der induzierten DSB DNA-Schäden und deren Reparatur bis zu 72 h nach Bestrahlung in Abhängigkeit von der Strahlbreite:
Nach der 920 µm-Breitfeldbestrahlung zeigen sich viele Zellen mit DSB Schäden im Zellkern (A), jedoch weisen diese Zellkerne nur wenige Schäden auf (B). Dahingegen ist die durchschnittliche Anzahl der Zellen mit DSB nach der fokussierten PMBRT ähnlich zur Kontrolle (A). 72 h nach der Breitfeldbestrahlung sind sehr viele Zellen mit einem starken DNA-Schaden (pan-γH2AX-Signal) zu finden (C). Zellen im Zelltod (aktive Caspase-3, Apoptose) stiegen nur in den bestrahlten Modellen 6 h nach der Bestrahlung deutlich an (D).
Fazit
Die durchgeführte Arbeit konnte zum ersten Mal nachweisen, dass sich durch fokussierte Protonen-MinibeamBestrahlung eine im Vergleich zu einer Breitfeldbestrahlung günstigere DNA-Schadensverteilung und eine Aussparung des nicht-bestrahlten Normalgewebes in der exponierten Epidermis erzielen lässt. Dies untermauert, dass die Protonen-Minibeam-Strahlentherapie die Methode der Wahl in der klinischen Tumortherapie sein könnte, da sie im Vergleich zur konventionellen homogenen Bestrahlung zu einer signifikanten Reduktion der Schädigung des ausgesparten oberflächlichen Gewebes führt.
Ein wesentlicher Nebeneffekt ist, dass sich mit der neu etablierten molekularzytologischen Nachweismethode die einsatzrelevanten diagnostischen Möglichkeiten in der Erkennung von Med-A-Schäden nach einer Exposition mit ionisierender Strahlung erweitern lassen.
Literatur
- Ahmed EA, Agay D, Schrock G et al.: Persistent DNA Damage after High Dose In Vivo Gamma Exposure of Minipig Skin. Plos One 2012; 7(6): e39521. mehr lesen
- Girst S, Greubel C, Reindl J et al.: Proton Minibeam Radiation Therapy Reduces Side Effects in an In Vivo Mouse Ear Model. Int J Radiat Onco Biol Phys 2016; 95(1): 234-241. mehr lesen
- Hauptner A, Dietzel S, Drexler GA et al.: Microirradiation of cells with energetic heavy ions. Radiat Environ Biophys 2004; 42(4): 237-245. mehr lesen
- Reindl J, Girst S: pMB FLASH – Status and Perspectives of Combining Proton Minibeam with FLASH Radiotherapy. J Cancer Immunol 2019. 1(1): 14-23. mehr lesen
- Sammer M, Teiluf K, Girst S et al.: Beam size limit for pencil minibeam radiotherapy determined from side effects in an in-vivo mouse ear model. PLoS One 2019; 14(9): e0221454. mehr lesen
- Zlobinskaya O, Girst S, Greubel C et al.: Reduced side effects by proton microchannel radiotherapy: study in a human skin model. Radiat Environ Biophys 2013; 52(1): 123-133. mehr lesen
Manuskriptdaten
Zitierweise
Wagner SQ, Reindl J, Grundhöfer J, Müller J, Sammer M, Schoof S, Müller S, Rudigkeit S, Matejka N, Port M, Scherthan H: Histologische Analyse von Doppelstrangbrüchen in protonenbestrahlten 3D-Hautmodellen (Vortragsabstract).WMM 2021; 65(11): S11-S13.
Verfasserin
Leutnant SanOA Stephanie-Quinta Wagner
Institut für Radiobiologie der Bundeswehr
Neuherbergstr. 11, 80937 München
E-Mail: stephanie-quinta.wagner@gmx.de
Vortrag beim Wettbewerb um den Heinz-Gerngroß-Förderpreis der Deutschen Gesellschaft für Wehrmedizin und Wehrpharmazie e. V. am 15. Oktober 2021 in Koblenz