Radiobiologische Effekte der modernen Computertomografie –
Einblicke in die Genexpression, Epigenetik und DNA-Schädigung peripherer Blutzellen nach CT-Bestrahlung (Vortrags-Abstract)
Hanns Leonhard Kaatscha
a Institut für Radiobiologie der Bundeswehr in Verbindung mit der Universität Ulm, München
Einleitung
Die Computertomografie (CT) ist ein fest etabliertes bildgebendes Verfahren in der medizinischen Diagnostik, welches häufig im Rahmen der sanitätsdienstlichen Versorgung von Soldatinnen und Soldaten im In- und Ausland angewendet wird. Die fortschreitende technologische Entwicklung dieser Untersuchungsmethode führt zu einer stetig sinkenden Dosisbelastung durch Einzeluntersuchungen, jedoch bestehen bis heute Unsicherheiten bei der Bewertung des Langzeitrisikos durch eine Strahlenbelastung im typischen Niedrigdosisbereich moderner CT-Diagnostik [1][2]. Auch mögliche Unterschiede in der biologischen Wirksamkeit innovativer Untersuchungstechniken, wie z. B. aufgrund der Verwendung von niedrigenergetischen Röntgenstrahlen im Rahmen der Dual-Energy CT-Technik (DECT), sind bisher nicht ausreichend aufgeklärt. Hier bedarf es weiterer Erkenntnisse hinsichtlich der durch die CT-Exposition hervorgerufenen biologischen Prozesse auf Zellebene.
Biologische Indikatoren für Strahlenwirkungen
Strahlungsbedingte zelluläre Prozesse können anhand von biologischen Indikatoren im Rahmen der biologischen Dosimetrie sichtbar gemacht und untersucht werden. So wird diese Methode bei Verdacht auf eine übermäßige Strahlenbelastung durch hohe Dosiswerte und einer möglichen Manifestation der akuten Strahlenkrankheit zum Nachweis sowie zur Dosisabschätzung im Medizinischen A-Schutz standardmäßig verwendet. Im Niedrigdosisbereich unterhalb von 100 mSv hingegen ist die exakte Bestimmung der absorbierten Dosis eine Herausforderung für etablierte Standard-Nachweisverfahren (Dizentrikanalyse) der biologischen Dosimetrie [5]. Im Hinblick auf die Triage einer großen Anzahl potenziell strahlenexponierter Personen bei radionuklearen Großschadenslagen, wie z. B. terroristischen Anschlägen oder nuklearen Angriffen, ist die eindeutige Identifikation nicht oder gering exponierter Personen jedoch essenziell, um ressourcenschonende medizinische Entscheidungen treffen zu können. Die Erprobung alternativer Verfahren zum sicheren Nachweis einer Niedrigdosisexposition ist in diesem Zusammenhang notwendig.
Mit Hilfe moderner molekularbiologischer Verfahren könnten einerseits wichtige Erkenntnisse zu zellulären Prozessen nach CT-Exposition und somit fundiertes Wissen für die Risikobewertung dieser diagnostischen Methode gewonnen sowie andererseits das Methodenspektrum der biodosimetrischen Diagnostikwerkzeuge des medizinischen A-Schutzes im Niedrigdosisbereich erweitert werden. Daher wurden in unseren Untersuchungen die Auswirkungen von CT-Bestrahlung auf die Genexpression und DNA-Methylierung mittels „Next-Generation-Sequencing“-Technologie sowie mögliche DNA-Schädigungen mittels Immunfloureszenzfärbung in peripheren Blutzellen untersucht.
Methoden
Periphere Blutzellen dreier Probanden wurden ex vivo in einem modernen Dual-Source-CT-Scanner (DSCT) mit Dosiswerten < 10 mSv bestrahlt. Zunächst erfolgte zur Identifikation eines transkriptionell interessanten Zeitpunktes eine RNA-Hochdurchsatz-Sequenzierung (RNA-Seq) nach Exposition anhand eines konventionellen Single-Energy-CT (SECT)-Protokolls (150 kV) und 1 h bzw. 6 h Inkubation. In weiteren Untersuchungen erfolgte eine Exposition anhand von SECT- und DECT-Protokollen (80 kV, 150 kV und 80 kV/Sn150 kV) und eine Genexpressionsanalyse mittels RNA-Hochdurchsatz-Sequenzierung. Potenzielle Kandidatengene der Genexpressionsauswertung wurden mittels quantitativer Echtzeit-PCR (qRT-PCR) validiert. Zusätzlich wurde bei identischen CT-Protokollen eine Methylierungsanalyse mittels DNA-Hochdurchsatz-Sequenzierung (Methyl-Seq) nach 6 h Inkubation post-CT sowie die Quantifizierung von DNA-Doppelstrangbrüchen (DNA-DSB) 30 min post-CT mittels γ-H2AX + 53BP1-Co-Immunfluoureszenzfärbungsverfahren durchgeführt. Unbestrahlte Blutproben dienten in sämtlichen Untersuchungen als Kontrollgruppe.
Ergebnisse
Die bioinformatische Auswertung der RNA-Sequenzdaten zeigte im Rahmen der explorativen Analyse zunächst primär probandenspezifische Unterschiede der Genexpressionsprofile (Abbildung 1) und insgesamt geringe Gesamteffekte der CT-Exposition. Die gezielte Suche nach differenziell exprimierten Genen erbrachte dennoch eine signifikante Hochregulierung von insgesamt fünf strahleninduzierten Genen – AEN, BAX, DDB2, EDA2R und FDXR – 6h post-CT (Abbildung 2), welcheunabhängig von den verwendeten SECT- und DECT-Protokollen gleichermaßen in allen Probanden nachgewiesen werden konnte. Für den Zeitpunkt 1 h nach CT-Bestrahlung wurde kein Einfluss auf die Genregulation gefunden.
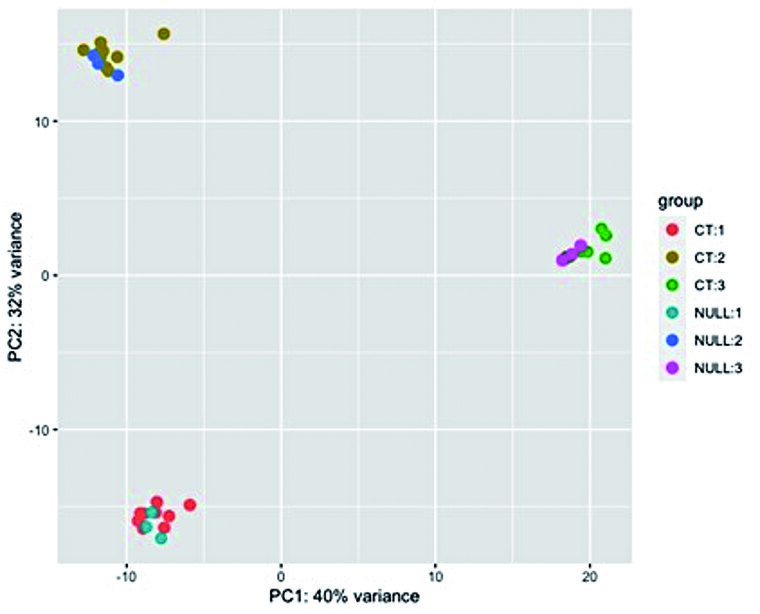
Abb. 1: Hauptkomponentenanalyse (Principal Component Analysis) der Genexpressionsdaten: Es zeigen sich entsprechend der Probandenanzahl drei Cluster der bestrahlten (CT) und nicht-bestrahlten (NULL) Proben, welche sich strahlungsunabhängig anordnen und somit die primär interindividuellen Unterschiede der Genexpressionsprofile darlegen. Die Abbildung basiert auf Daten aus [4].
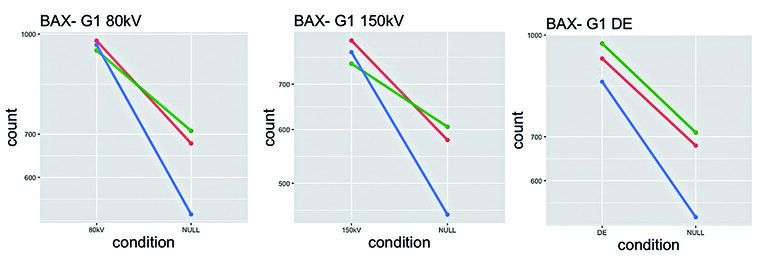
Abb. 2.: Exemplarische Genexpressionsplots eines Probanden (G1) für das Gen BAX 6 h nach 80kV, 150kV und Dual-Energy-CT-Exposition: Dargestellt ist die Anzahl der BAX-zugehörigen Sequenzfragmente der bestrahlten (80kV/150kV/DE) und nicht-bestrahlten (NULL) Proben mit entsprechenden Replikaten (blau, rot oder grün). Nach CT-Bestrahlung zeigt sich im Vergleich zur nicht-bestrahlten Kontrollprobe in allen Konditionen ein Anstieg der Sequenzfragmente als Zeichen einer Hochregulierung dieses Gens. Die Abbildung basiert auf Daten aus [3].
Die Quantifizierung von DNA-Doppelstrangbrüchen zeigte ein signifikant höheres Auftreten von DNA-DSB-Foci (p<0,001) ebenfalls nach allen CT-Expositionen und in allen Probanden. Hier ergaben sich durchschnittliche DNA-DSB-Foci pro Zelle von 0,78 ± 0.077 für 80kV, 0,78 ± 0,069 für 150kV und 0,73 ± 0,073 für DECT (Abbildung 3). Der Unterschied in der Foci-Anzahl zwischen DECT- und den SECT-Protokollen erreichte keine statistische Signifikanz (p > 0.15). Durch die explorative und differenzielle Analyse der DNA-Methylierungsmuster konnten keine strahlungsspezifisch veränderten Genorte und -regionen identifiziert werden. Zudem wurde anhand sämtlicher untersuchter radiobiologischer Endpunkte kein Hinweis auf eine erhöhte biologische Wirksamkeit der niedrigenergetischen Röntgenstrahlung der DECT-Technik gefunden.
Diskussion
In unseren Untersuchungen konnten wir zeigen, dass moderne CT-Diagnostik Veränderungen der Genexpression durch Hochregulierung von fünf strahlungsinduzierbaren Genen – AEN, DDB2, FDXR, BAX und EDA2R –, sowie DNA-DSB in peripheren Blutzellen früh nach ex vivo Exposition hervorruft. Interessanterweise stehen diese Gene im direkten Zusammenhang mit Apoptose, DNA-Reparatur sowie Zellzykluskontrolle. Somit kann festgehalten werden, dass trotz stetig fortschreitender Gerätetechnologie mit sinkender Dosisbelastung einzelner Untersuchungen weiterhin Auswirkungen der modernen CT-Diagnostik auf die Genomintegrität und Genregulation nachweisbar sind. Diese Erkenntnisse sind bei einer sorgfältigen Indikationsstellung vor CT-Untersuchungen im Rahmen der sanitätsdienstlichen Versorgung zu beachten. Hinweise auf eine erhöhte biologische Wirksamkeit niedrigenergetischer Röntgenstrahlung der DECT-Technik wurden anhand der untersuchten biologischen Endpunkte nicht gefunden. Hierdurch kann eine bisher unzureichende Studienlage fundiert ergänzt und unmittelbar zur klinischen Anwendungssicherheit dieser Technik beigetragen werden. Gleichzeitig gilt es, unsere Ergebnisse anhand von weiteren in vivo Untersuchungen zu bestätigen.
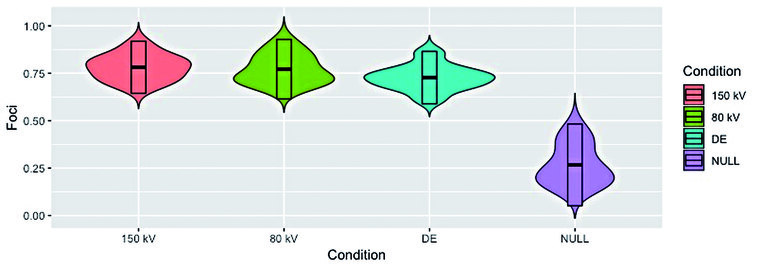
Abb. 3: Violinplot mit durchschnittlicher Anzahl der DNA-Doppelstrangbruch-Foci pro Zelle der bestrahlten (150 kV, 80 kV und DE) sowie nicht-bestrahlten (NULL) Proben: Der integrierte Boxplot zeigt das erste und dritte Quartil sowie den Median. Nach CT-Bestrahlung ist eine signifikante Zunahme der Foci (p < 0.001) zu erkennen. Der anzunehmende Unterschied in der Foci-Anzahl nach DECT verglichen zu 150 kV und 80 kV SECT erreichte keine statistische Signifikanz (p > 0.15). Die Abbildung basiert auf Daten aus [3].
Die Analyse von DNA-Methylierungsprofilen peripherer Blutzellen zum 6-Stunden-Zeitpunkt post-CT erbrachte keinen Hinweis auf strahlungsinduzierte Störungen dieses wichtigen epigenetischen Mechanismus, welcher unmittelbar Einfluss auf die Genregulation und Genomintegrität besitzt. Letztlich sind geringe Effekte in einzelnen Zellen jedoch nicht sicher auszuschließen, welche sich erst bei der Ausweitung der untersuchten Zeitpunkte in Form von Langzeiteffekten ausprägen könnten.
Angesichts der bewiesenen Sensitivität der Genexpressions- und DNA-Doppelstrangbruchanalysen, eine Dosisbelastung unter 10mSv erfolgreich nachweisen zu können, wurde eine aussichtsreiche Grundlage für die weitere Erforschung und Etablierung dieser Verfahren als mögliches biodosimetrisches Diagnostik-Werkzeug bei der Detektion von Niedrigdosisbestrahlung für den medizinischen A-Schutz geschaffen. Hingegen erscheint die DNA-Methylierungsanalyse mittels Hochdurchsatz-Sequenzierung (Methyl-Seq) für den Nachweis einer einmaligen Strahlenexposition im Niedrigdosisbereich ungeeignet, nicht zuletzt auch aufgrund eines deutlich höheren Aufwandes in der Probenaufbereitung. Der hier erbrachte Nachweis von DNA-DSB nach moderner CT-Diagnostik bietet zudem vielversprechende Ansatzpunkte für weitere radiobiologische Untersuchungen mittels Hochdurchsatz-Sequenzierung. So könnte die genomweite basengenaue Kartierung von DNA-Doppelstrangbrüchen (BLISS-Methode) weitere wichtige Erkenntnisse zur Risikobewertung moderner CT-Diagnostik liefern sowie eine Ergänzung des biodosimetrischen Methodenspektrums für den medizinischen A-Schutz sein.
Literatur
- Abbott A: Researchers pin down risks of low-dose radiation. Nature 2015; 523(7558): 17-18. mehr lesen
- Ali YF, Cucinotta FA, Ning-Ang L, Zhou G: Cancer Risk of Low Dose Ionizing Radiation. Front Phys 2020; 8: 234. mehr lesen
- Kaatsch HL, Becker BV, Schüle S et al.: Gene expression changes and DNA damage after ex vivo exposure of peripheral blood cells to various CT photon spectra. Sci Rep 2021; 11(1): 12060. mehr lesen
- Kaatsch HL, Majewski M, Schrock G et al.: CT Irradiation-induced Changes of Gene Expression within Peripheral Blood Cells. Health Phys 2020; 119(1): 44-51. mehr lesen
- Pernot E, Hall J, Baatout S et al.: Ionizing radiation biomarkers for potential use in epidemiological studies. Mutat Res 2012; 751(2): 258-286. mehr lesen
Manuskriptdaten
Zitierweise
Kaatsch HL: Radiobiologische Effekte der modernen Computertomografie – Einblicke in die Genexpression, Epigenetik und DNA-Schädigung peripherer Blutzellen nach CT-Bestrahlung (Vortrags-Abstract).WMM 2021; 65(11): S8-S10.
Verfasser
Oberstabsarzt Dr. Hanns Leonhard Kaatsch
Institut für Radiobiologie der Bundeswehr
Neuherbergstr. 11, 80937 München
E-Mail: : hannsleonhardkaatsch@bundeswehr.org
Vortrag beim Wettbewerb um den Heinz-Gerngroß-Förderpreis der Deutschen Gesellschaft für Wehrmedizin und Wehrpharmazie e. V. am 15. Oktober 2021 in Koblenz