SARS-CoV2 – Trigger oder Auslöser einer klassischen Rheumaerkrankung? (Poster-Abstract)
Daniel Gagiannisa, Annika Czecha, Carsten Hackenbrochb, Konrad Steinestelc
a Bundeswehrkrankenhaus Ulm, Klinik I – Innere Medizin/Pneumologie
b Bundeswehrkrankenhaus Ulm, Abteilung VIII – Radiologie
c Bundeswehrkrankenhaus Ulm, Institut für Pathologie und Molekularpathologie
Hintergrund
Die Coronavirus-Krankheit 2019 (COVID-19) hat sich 2020 zu einer weltweiten Pandemie entwickelt. Es besteht nach wie vor eine große Unsicherheit über mögliche langzeitbedingte Folgen. Etwa 10 % der Patienten berichten von anhaltender Müdigkeit, Muskelschwäche oder Atemnot bei Belastung [1]. Die Arbeitsgruppe COVID-19 am BwKrhs Ulm hat bereits zu Beginn der Pandemie über den Nachweis von antinukleären Autoantikörpern/extrahierbaren nuklearen Antigenen (ANA/ENA) im Zusammenhang mit Autoimmunerkrankungen bei Patienten während der akuten Phase des schweren COVID-19 berichtet [4]. Bislang besteht kein Konsens über den zugrunde liegenden Pathomechanismus sowie die Diagnosekriterien des pulmonalen Long- bzw. Post-COVID-Syndroms. Bei einem Teil zuvor gesunder, überwiegend junger und sportlicher Patienten der Long-COVID-Ambulanz am Bundeswehrkrankenhaus (BwKrhs) Ulm fielen uns mögliche Parallelen zu einer Lungenbeteiligung bei Erkrankungen aus dem rheumatologischen Formenkreis auf. Wir streben daher ein besseres Verständnis der dem Long- bzw. Post-COVID-Syndrom zugrunde liegenden Pathomechanismen an, um durch ggf. gezielte therapeutische Intervention anhaltenden Beeinträchtigungen der Leistungsfähigkeit entgegenzuwirken.
Einschlusskriterien und Diagnostik
Wir rekrutierten prospektiv 33 zuvor gesunde Patienten ohne Anamnese für eine rheumatische Grunderkrankung, welche sich nach einer leicht oder mittelschwer verlaufenden SARS-CoV-2-Infektion in der Long-COVID-Ambulanz des BwKrhs Ulm vorstellten. Der Großteil der Patienten waren Polizeibeamte und Soldaten, das mediane Alter betrug 39 (21–61) Jahre. Neben einer vollständigen Anamnese für interstitielle Lungenerkrankungen (ILD) führten wir Lungenfunktionstests einschließlich einer Spiroergometrie, eine Computertomographie (CT) sowie eine serologische Analytik für antinukleäre Antikörper (ANA, indirekte Immunfluoreszenz) bzw. extrahierbare nukleäre Antigene (ENA, Immunoblot) durch. Die klinischen Daten sowie die Ergebnisse der Lungenfunktionsuntersuchungen fasst Tabelle 1 zusammen.
Tab 1: Klinische Daten und Ergebnisse der Lungenfunktionsuntersuchung
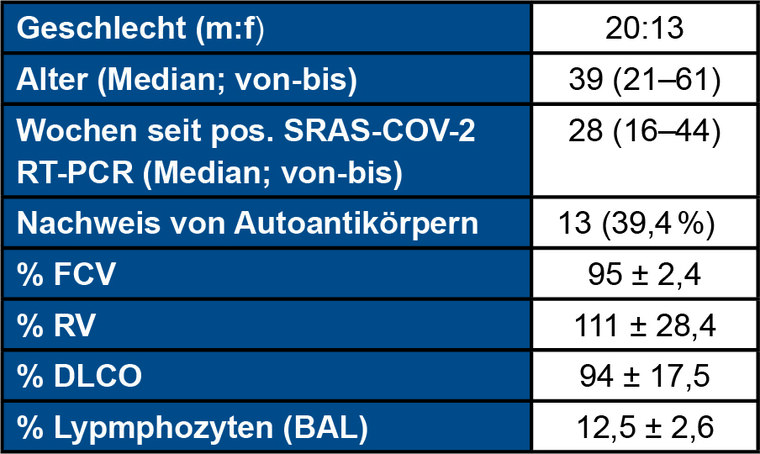
m, männlich; f, weiblich; FVC, forcierte Vitalkapazität; RV, Residualvolumen; DLCO, Diffusion Capacity of the Lungs for Carbon Monoxide; BAL, broncho-alveoläre Lavage. aANA titer ≥ 1:320 und/oder positiver Immunoblot (Scl 70, PCNA, PM Scl , dsDNA, SS B, Histone) oder Rheumafaktoren > 20 U/ml.
Bei 29 Patienten wurden neben einer bronchoalveolären Lavage (BAL) einschließlich Immunzytologie auch transbronchiale Biopsien (TBBs) zur histopathologischen Beurteilung einer möglichen interstitiellen Lungenerkrankung entnommen. Eine zustimmende Bewertung der Ethikkommission der Universität Ulm (Nr. 129/20 bzw. 331/20) liegt vor.
Vorläufige Ergebnisse
Klassische Lungenfunktionsparameter präsentierten sich weitestgehend als unauffällig. Einzig das Residualvolumen bewegte sich im Vergleich zu einem gesunden Normkollektiv auf einem etwas erhöhten Niveau und wird als Ausdruck einer terminalen Bronchiolitis diskutiert. In der CT wurde kein klassisches ILD-Muster registriert. Nur vereinzelt zeigten sich subpleurale Retikulationen und dezente Milchglasverdichtungen (Abbildung 1). Zusätzlich fielen bei allen Patienten im Vergleich zu den begleitenden Bronchien pathologisch erweiterte Pulmonalgefäße auf (Abbildung 2). Bei 13/33 Patienten (39,4 %) waren ANA-Titer ≥ 1:320 oder spezifische ENA (a-Scl-70, a-PM-Scl, a-dsDNA, a-SS-B und a-Histone) nachweisbar. Die BAL zeigte bei fast allen Patienten eine leichtgradige, bei einigen Patienten eine mittel- bis schwergradige Lymphozytose mit jeweils ausgeglichener CD4/CD8-Ratio. Histopathologisch waren in den meisten Fällen alveoläre Fibrinausschwitzungen sowie eine Vermehrung des interstitiellen Entzündungsinfiltrats erkennbar, bei vier Patienten zeigte sich eine organisierende Pneumonie (OP) mit alveolären Fibroblastenplugs (Abbildung 3). Eine ultrastrukturelle Analyse ließ eine diskrete interstitielle Ablagerung von Kollagenfasern erkennen (Abbildung 4).
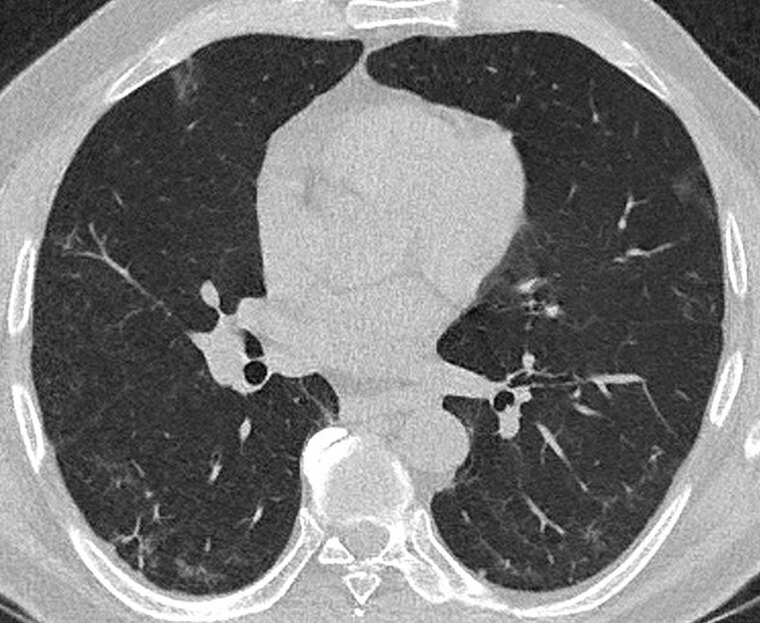
Abb. 1: Post-COVID Follow-up-Untersuchung: Axiales Normaldosis-CT 9 Monate nach primärer Infektion mit subpleuralen Retikulationen und flauen Milchglasverdichtungen
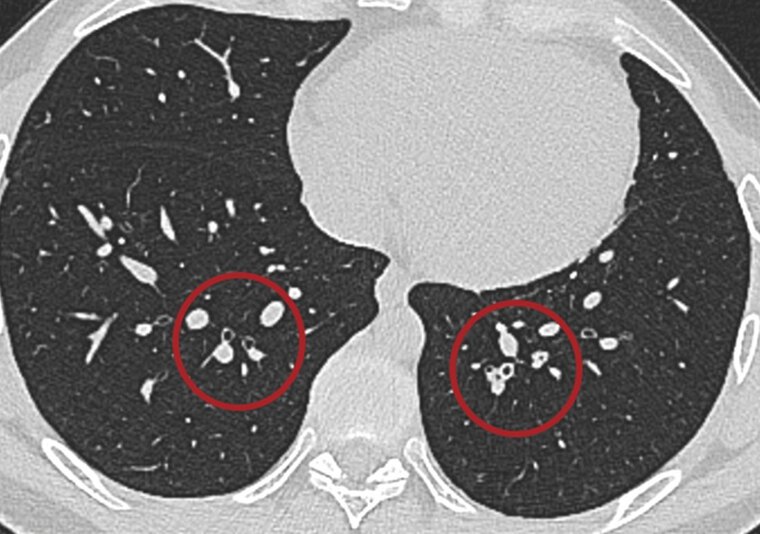
Abb. 2: In der HRCT präsentieren sich keine klassischen NSIP-Muster. Neben Bronchialwandverdickungen und leicht erniedrigten Lungedichtewerten fallen bei 33/33 Patienten signifikant erweiterte pulmonale Gefäße auf.
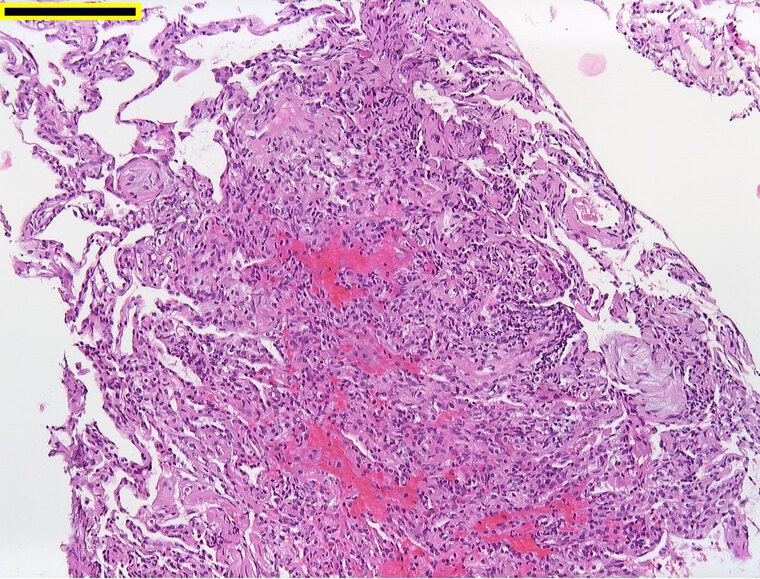
Abb. 3: Transbronchiale Biopsie. Es zeigt sich eine Vermehrung interstitieller Entzündungszellen mit alveolärer Fibrinausschwitzung sowie vereinzelte intraalveoläre Fibroblastenplugs (organisierende Pneumonie). Balken: 200µm
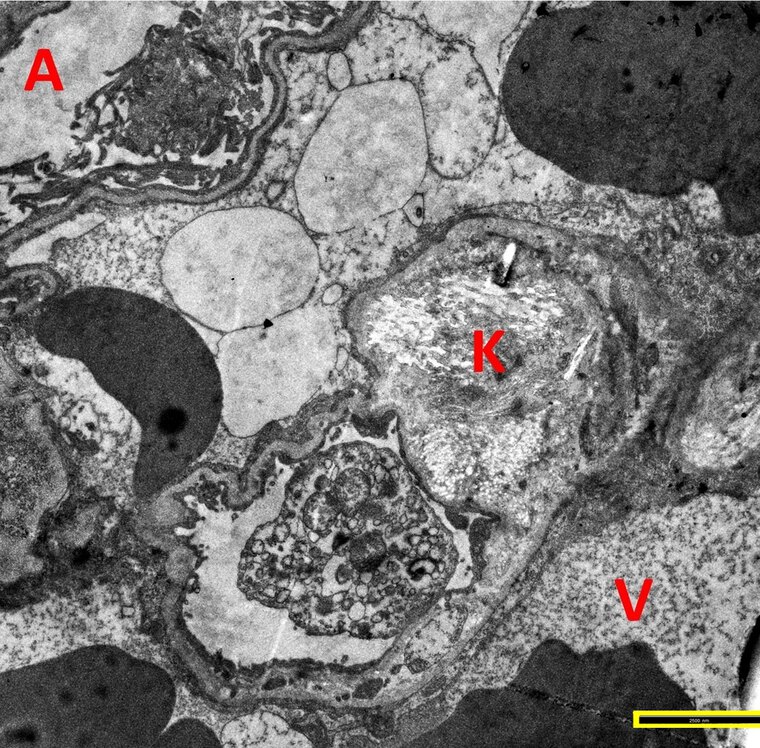
Abb. 4: Elektronenmikroskopische Aufnahme: Interstitielle Ablagerung von Kollagenfasern (K), Alveolarlichtung (A), Blutgefäß (V); Balken: 2,5 µm
Schlussfolgerung
Die isolierte Betrachtung von lungenfunktionellen, radiologischen oder histopathologischen Merkmalen von pulmonalem Long-/Post-COVID ist als eher unspezifisch zu bewerten. Hier gilt es, die Einzelmerkmale zu einem Gesamtbild zusammenzufügen. Insgesamt weisen die Befunde auf eine Entzündung der kleinen Atemwege mit konsekutiver Erhöhung des Residualvolumens hin (sog. „small airway disease“), wie sie auch von anderen Autoren im Kontext von Long-/Post-COVID diskutiert wird [2], ohne dass bislang histopathologische Befunde hierzu vorlagen. Die Pathophysiologie hinter dieser Entzündung ist noch unzureichend verstanden, es gibt allerdings deutliche Hinweise darauf, dass es auch nach mild verlaufender COVID-19 zu einer anhaltenden Bildung von Autoantikörpern kommen kann. Die Heranziehung der klinischen, serologischen und radiologischen Befunde würde bei Patienten mit Nachweis von Autoantikörpern die Diagnose einer „interstitiellen Pneumonie mit autoimmunen Merkmalen“ (IPAF) ermöglichen, wie sie 2015 von der „ERS/ATS-Task-Force“ vorgeschlagen wurde (Tabelle 2) [3].
Tab 2: Klassifikationskriterien für die interstitielle Pneumonie mit autoimmunen Merkmalen (modifiziert nach [1])

HRCT, hochauflösende Computertomografie; ANA, antinukleäre Antikörper; ENA, extrahierbare nukleäre Antikörper; RF, Rheumafaktoren; NSIP, nicht-spezifische interstitielle Pneumonie; OP, organisierende Pneumonie.
Als optimale Screening- und Verlaufsdiagnostik von Long-/Post-COVID-Patienten hat sich aus unserer Sicht die Spiroergometrie erwiesen, da hierüber eine frühzeitige und objektivierbare pulmonale Leistungseinschränkung entlarvt werden kann. Da die IPAF oder andere kollagenose-assoziierte interstitielle Lungenerkrankungen (CTD-ILD) einen Progress zur Fibrose zeigen können, sollten die Persistenz von Autoantikörpern sowie eine pulmonale Rekrutierungsstörung engmaschig überwacht werden. Darüber hinaus sollte bei einem Progress der initial detektierten Auffälligkeiten eine auf das rheumatologische Patientenprofil zugeschnittene Therapiestrategie angewendet werden, um möglichst ein Fortschreiten der interstitiellen Fibrose zu verhindern.
Literatur
- Carfì A, Bernabei R, Landi F: Persistent symptoms in patients after acute COVID-19. Jama 2020; 324(6): 603-605. mehr lesen
- Cho JL, Villacress R, Nagpal P et al.:, (2021) Small Airways Disease is a Post-Acute Sequelae of SARS-CoV-2 Infection. medRxiv 2021.05.27.2125794. mehr lesen
- Fischer A, Antoniou KM, Brown KK, et al.: An official European Respiratory Society/American Thoracic Society research statement: interstitial pneumonia with autoimmune features. European Respiratory J.2015; 46(4): 976-987. mehr lesen
- Gagiannis D, Steinestel J, Hackenbroch C et al.: Clinical, Serological, and Histopathological Similarities Between Severe COVID-19 and Acute Exacerbation of Connective Tissue Disease-Associated Interstitial Lung Disease (CTD-ILD). Frontiers in immunology 2020; 11: 2600. mehr lesen
Für die Verfasser
Oberfeldarzt Dr. Daniel Gagiannis
Bundeswehrkrankenhaus Ulm
Klinik für Innere Medizin – Pneumologie
E-Mail: danielgagiannis@bundeswehr.org
Das Poster wurde beim 52. Jahreskongress der Deutschen Gesellschaft für Wehrmedizin und Wehrpharmazie e. V. am 16. Oktober 2021 mit dem 1. Preis im Posterwettbewerb der Gesundheitseinrichtungen ausgezeichnet.