MEDIZINISCHER C-SCHUTZ
Hochdruckpräparation und Charakterisierung von mikrosomalen Zellmembranfragmenten zur Gewinnung von nAChR aus T. californica (Poster-Abstract)
Fabian Springera, b, Marian Freislebena, Thomas Seegera, Horst Thiermanna, Franz Woreka, Lorenz Meinelb, Karin V. Niessena
a Institut für Pharmakologie und Toxikologie der Bundeswehr, München
b Lehrstuhl für Pharmazeutische Technologie und Biopharmazie Universität Würzburg
Einleitung
Phosphororganische Verbindungen wie Nervenkampfstoffe (OPC) hemmen die Acetylcholinesterase (AChE) im synaptischen Spalt, was eine Akkumulation von Acetylcholin bewirkt. Infolge der dadurch verursachten Überstimulation nikotinischer (nAChR, Abbildung 1A) und muskarinischer Acetylcholinrezeptoren (mAChR) kommt es zu einer cholinergen Krise, die unbehandelt zum Tod durch zentrales und peripheres Atemversagen führt. Bei der Aktivierung der quergestreiften Muskulatur über Motoneuronen spielt besonders der nAChR eine entscheidende Rolle. Bei einigen OPC-Vergiftungen ist die derzeitige Therapie mit den Antidoten Obidoxim und Atropin limitiert. Daher sind Wirkstoffe, die direkt am nAChR interagieren und dessen Dysfunktion beseitigen, eine äußerst interessante Therapieoption.
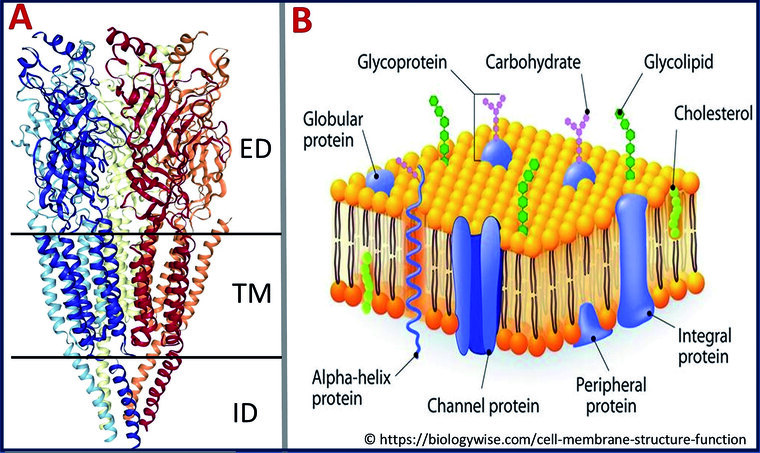
Abb. 1: (A) 3D-Struktur des Torpedo marmorata Muskeltyp nAChR (ED = Extrazelluläre Domäne, TD = Transmembran-Domäne, ID = Intrazelluläre Domäne) (B) Schematische Abbildung der Zellmembran: Der nAChR ist ein Ionenkanal bzw. Transmembranprotein (blau).
Für ein effektives Screening geeigneter Wirkstoffe sind in vitro-Experimente mit Zellmembranfragmenten, die möglichst hohe Mengen nAChR enthalten, neben weiteren Testmodellen nötig. Das elektrische Organ des kalifornischen Zitterrochens (Torpedo californica) ist eine sehr reichhaltige Quelle für nAChR. Die Methoden für den Gewebeaufschluss müssen so konzipiert sein, dass möglichst viele Rezeptoren gewonnen werden und deren Denaturierung möglichst gering ausfällt. In dem vorliegenden Projekt wurde eine neue Methode entwickelt, nAChR-haltige Membranfragmente schnell und möglichst schonend mittels Hochdruckhomogenisation aus nativem Gewebe zu gewinnen.
Methode
Aus dem elektrischen Organ des kalifornischen Zitterrochens (Torpedo californica) wurden durch Differenzial-Zentrifugation mikrosomale Zellmembranfragmente, die reich an nAChR-Subtyp 2αβδγ (Muskeltyp-nAChR) sind, hergestellt. Etwa 50 g gefrorenes Gewebe (-150 °C) wurden in Extraktionspuffer (20 mM NaPi (= Na2HPO4/NaH2PO4), 400 mM NaCl, 2 mM EDTA, 0,1 mM PMSF) bei Raumtemperatur für 4 min aufgetaut. Anschließend wurde das Material temperiert (30 min, 4 °C) und mittels Ultra-Turrax (13 500 U/min) für 1–2 min homogenisiert. Zur Abtrennung von löslichen Bestandteilen wurde die Suspension durch Ultra-Zentrifugation (90 min, 27 000 x g, 4 °C) pelletiert. Das erhaltene Pellet wurde zweimal in Waschpuffer (20 mM NaPi, 2 mM EDTA, 0,1 mM PMSF) durch erneute Ultrazentrifugation (60 min, 37 000 x g, 4 °C) gewaschen. Modifizierter Waschpuffer (10 mM NaPi, 120 mM NaCl, 2 mM EDTA, 5 mM KCl) wurde im Verhältnis 9 : 1 zugegeben. Das gewaschene Pellet wurde resuspendiert und das Bindegewebe durch einen Zentrifugationsschritt (10 s, 1 000 x g, 4 °C) entfernt.
Der Überstand wurde abgetrennt und mit modifiziertem Waschpuffer auf 250 ml aufgefüllt. Diese Suspension wurde zur Hochdruckhomogenisierung mit dem AVP- 2000 Laborhomogenisator (SPXflow Technology, Moers) eingesetzt (Abbildung 2). Die Homogenisation erfolgte mehrmals hintereinander (insgesamt 12 Durchläufe) und unter Anwendung der Drücke 200, 400, 600, 800, 1000 und 1200 bar, wobei zwischen den einzelnen Durchläufen Proben entnommen wurden. Das Homogenisat wurde in 50 ml Polypropylen-Röhrchen überführt und zentrifugiert (10 min, 1 000 x g, 4 °C). Der Überstand wurde erneut für die Ultrazentrifugation verwendet (30 min, 100 000 x g, 4 °C) und das Pellet wurde in Pelletpuffer (10 mM NaPi, 120 mM NaCl, 5 mM KCl) im Verhältnis 1 : 2 resuspendiert. Die mikrosomalen Zellmembranfragmente wurden bei -150 °C gelagert.
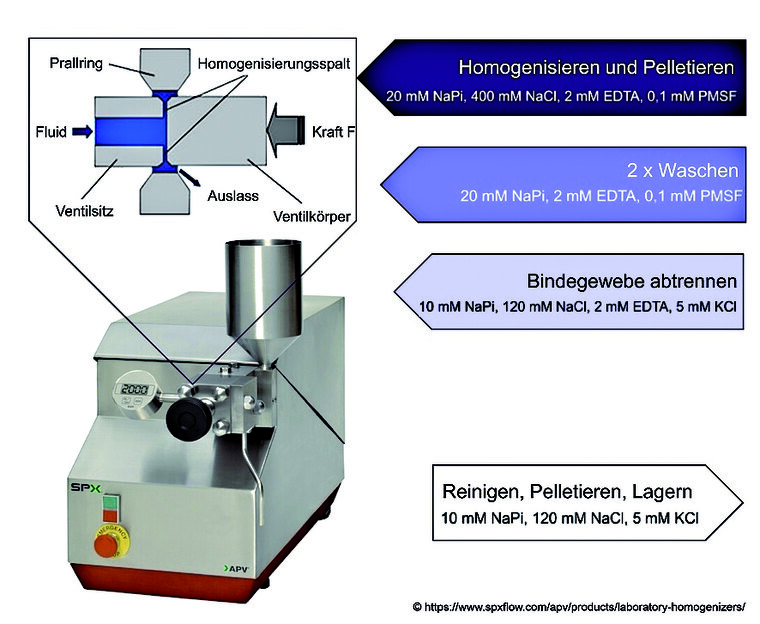
Abb. 2: Prinzip der Homogenisation mit dem AVP-2000 Laborhomogenisator (SPXflow-Technology, Moers): Das Detailbild zeigt die Flussrichtung von nativem Material durch den Homogenisationsspalt.
Die Charakterisierung der mikrosomalen Zellmembranfragmente erfolgte mittels Dynamic Light Scattering (DLS), Zeta-Potential Messung und Lichtmikroskopie. Mit einem Szintillation Proximity Assay (SPA) unter Verwendung von [³H]Epibatidin, eines hochaffinen nAChR-Agonisten, wurden die Affinitätskonstante KD und die maximale Anzahl der Bindungsstellen Bmax bestimmt.
Ergebnisse und Diskussion
Die Ergebnisse sind als Zusammenfassung in den Abbildungen 3 und 4 dargestellt:
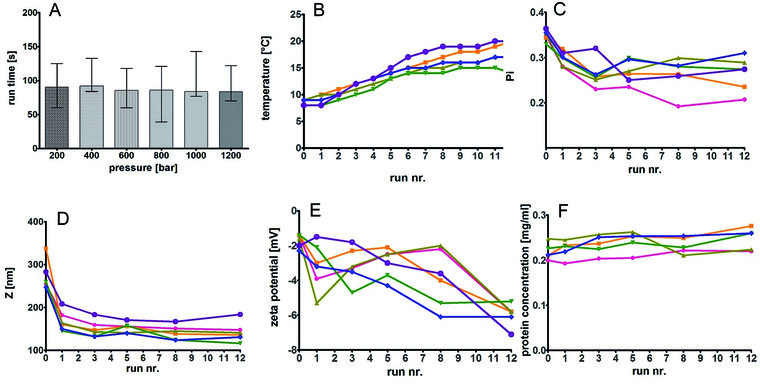
Abb. 3: Während der Hochdruck-Homogenisation wurden Drücke von 200 bar (lila), 400 bar (pink), 600 bar (gelb), 800 bar (oliv), 1000 bar (grün) und 1200 bar (blau) angewandt. Es wurde mit bis zu 12 Durchläufen (Passagen) homogenisiert.
Homogenisierungsläufe bei höheren Drücken bedingen keine längere Laufzeit (Abbildung 3A), allerdings steigt die Temperatur mit jeder Passage an (Abbildung 3B).
Der hydrodynamische Durchmesser (Z) und das Oberflächenpotential (Zeta-Potential) korrelieren direkt mit dem angewandten Druck (Abbildungen 3D und 3E).
Nach etwa fünf Durchläufen zeigen sich Polydispersitätsindex (Pi) als Maß der Partikelgrößenverteilung (Abbildung 3C) und Z-Mittelwert (Abbildung 3D) weitestgehend stabil. Die Proteinkonzentration, die mittels Bicinchoninsäure (BCA)-Assay als zusätzliches Qualitätskriterium bestimmt wurde, bleibt während der Passagen nahezu unverändert (Abbildung 3F).
Die Affinitätskonstante KD und die maximale Anzahl an Bindungsstellen Bmax wurden aus Sättigungsisothermen berechnet, die mittels SPA bestimmt wurden. Die Bmax-Werte reduzieren sich mit zunehmenden Druck, dagegen scheinen die KD-Werte unabhängig vom angewandten Druck zu sein (Abbildung 4A und 4B).
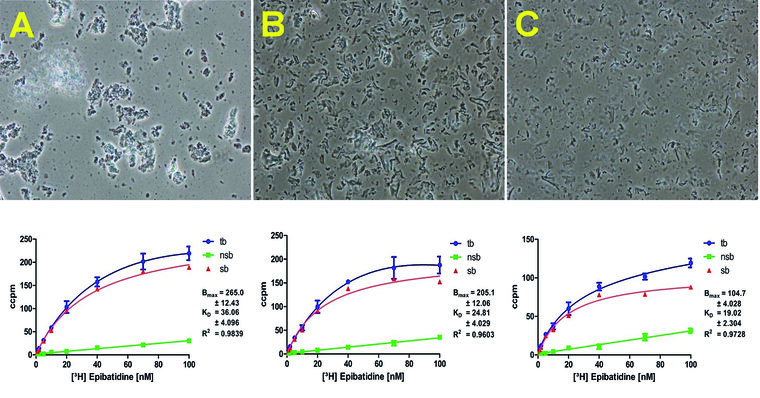
Abb. 4: Lichtmikroskopie (20x) der nAChR enthaltenen Zellmembranfragmente (obere Reihe) und die dazugehörigen Sättigungsisotherme mit [3H]Epibatidin (untere Reihe). (A) Manuelle Aufarbeitung mittels Dounce-Homogenisation, (B) Hochdruck-Homogenisation bei 400 bar, (C) Hochdruck-Homogenisation bei 1000 bar: Die Bilder zeigen die Korrelation zwischen Druck und Vesikelbeschaffenheit. Blaue Kurve: Gesamtbindung (tb), grüne Kurve: Nichtspezifische Bindung (nsb), rote Kurve: Spezifische Bindung (sb).
Der Rückgang der maximalen Anzahl an Bindungsstellen Bmax mit steigendem Druck kann über die damit verbundene Degradation der Rezeptoren erklärt werden (Abbildung 4C).
Es konnte gezeigt werden, dass die Hochdruckhomogenisierung überaus geeignet ist, die Dispersion und den Durchmesser von Vesikeln aus Zellmembranfragmenten zu minimieren. Dispersität, Zeta-Potential und Z-Durchmesser korrelieren direkt mit dem angewandten Druck. Die Ergebnisse zeigen, dass ein Druck von 400 bar während der Aufarbeitung für die effiziente und gleichzeitige schonende Gewinnung von nAChR am besten geeignet ist.
Fazit
Die hier dargestellte Methode erlaubt die Herstellung hoch standardisierter rezeptorhaltiger Membranfragmente, deren Verwendung für die Bilayer-basierte Elektrophysiologie (SSM- oder BLM-Techniken) besonders geeignet ist. Durch diese sehr effiziente Aufarbeitungsmethode wird der Screeningprozess, neue Wirkstoffe für die Behandlung von Nervenkampfstoffvergiftungen zu identifizieren, deutlich beschleunigt.
Für die Verfasser
Leutnant (SanOA) Fabian Springer
Institut für Pharmakologie und Toxikologie der Bundeswehr, München
E-Mail: fabian1springer@bundeswehr.org
Posterpräsentation beim 52. Jahreskongress der Deutschen Gesellschaft für Wehrmedizin und Wehrpharmazie e. V. am 15. Oktober 2021 in Koblenz.